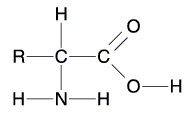
Proteine sind die Grundbausteine lebender Organismen und an allen Lebensvorgängen beteiligt. Sie sind höchst komplexe Makromoleküle, ihr Molekülgewicht schwankt zwischen 10000 und mehreren Millionen. Aminosäuren wiederum sind die Bausteine der Proteine. Kocht man Eiweiß mit HCl, so entsteht ein Gemisch aus Aminosäuren. In natürlichen Proteinen kommen ca. 20 Aminosäuren häufig vor, ca. 5 seltener. Aminosäuren bestehen aus den Elementen C; H, O, N und häufig ist auch S beteiligt.

Die allgemeine Formel lautet:
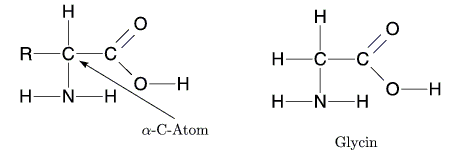
Die einfachste Aminosäure Glycin erhält man, falls R ein Wasserstoffatom
ist. Manche Aminosäuren wie Glutaminsäure haben eine zweite
Carboxylgruppe, andere wiederum wie Lysin eine zweite Aminogruppe.
Bei allen Aminosäuren, die aus natürlich vorkommenden Proteinen
gewonnen wurden, steht die Aminogruppe am ersten C-Atom, dem
sogenannten ![]() -C-Atom nach der Carboxylgruppe. Man spricht daher von
-C-Atom nach der Carboxylgruppe. Man spricht daher von
![]() -Aminosäuren.
-Aminosäuren.
Alle ![]() -Aminosäuren - außer Glycin - besitzen am
-Aminosäuren - außer Glycin - besitzen am ![]() -C-Atom 4 verschiedene
Substituenten. Das
-C-Atom 4 verschiedene
Substituenten. Das ![]() -C-Atom ist also ein asymmetrisches C-Atom.
-C-Atom ist also ein asymmetrisches C-Atom.
![]() Aminosäuren sind optisch aktiv.
Aminosäuren sind optisch aktiv.
Sie drehen die Schwingungsebene von linear polarisiertem Licht um einen bestimmten Winkel, der für die jeweilige Aminosäure spezifisch ist.
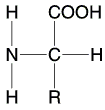
Die NH2-Gruppe steht in der Fischerprojektion links. In der D-From gibt es keine natürlichen Aminosäuren.
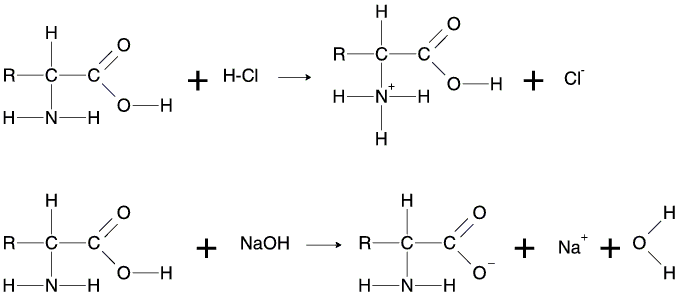
Sie können in wässriger Lösung Protonen abgeben bzw. aufnehmen, d.h. sie können sich wie eine Säure oder auch wie eine Base verhalten. In saurer Lösung trägt das Ion eine positive, in alkalischer Lösung eine negative Ladung.

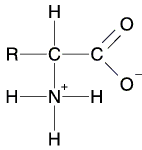
Die Aminosäuren treten als sogenannte „Zwitterionen“ auf, die man sich durch einen Protonenübergang innerhalb des Moleküls entstanden denken kann. Sie tragen sowohl eine negative als auch eine positive Ladung und sind nach außen elektrisch neutrale Moleküle. Aminosäuren sind feste Substanzen mit Schmelzpunkten von über 230oC. Die hohen Schmelzpunkte kommen daher, weil die Zwitterionen wie Salze Ionengitter ausbilden.
Bei Zugabe von wenig Säure bzw. wenig Lauge kann eine Pufferlösung den pH-Wert konstant halten.
In unpolaren Lösungsmitteln wie Alkohol sind sie jedoch nur schlecht löslich.
Für jede Aminosäure gibt es einen ganz bestimmten pH-Wert, bei dem sie in wässriger Lösung ausschließlich aus Zwitterionen besteht. Dieser pH-Wert wird als „isoelektrischer Punkt“ (IEP) der Aminosäure bezeichnet. Er ist von weiteren funktionellen Gruppen im Molekül abhängig.
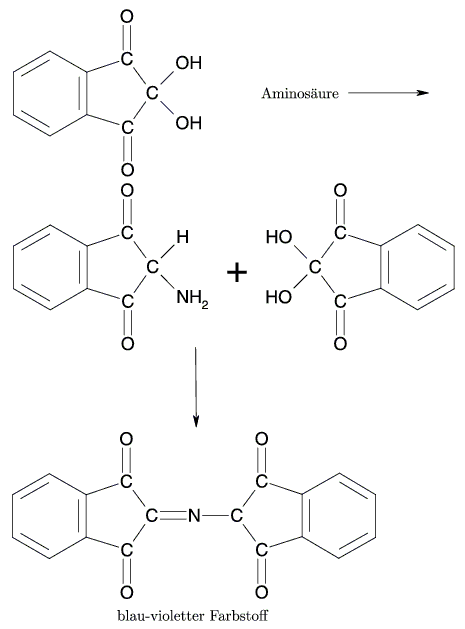
Stickstoff selbst wird in Aminosäuren folgendermaßen nachgewiesen :
Man versetzt eine Eiweißlösung mit einem Plätzchen Ätznatron und erwärmt vorsichtig. Die starke Natronlauge vertreibt dabei den leicht flüchtigen Ammoniak (NH3) aus ihrer Verbindung. Den Ammoniak erkennt man an der Blaufärbung von Indikatorpapier.
![]()
Die einfachste Aminosäure wurde 1820 als erste Aminosäure aus Gelatine in kristalliner Form isoliert. Als letzte Aminosäure wurde 1935 die Aminosäure Threonin entdeckt.
Aminosäuren, die der menschliche Körper nicht selbst aufbauen (synthetisieren) kann, nennt man essentielle Aminosäuren, sie müssen mit der Nahrung aufgenommen werden. Es sind dies: Arginin, Methionin, Phenylalanin, Threonin, Histidin, Isoleucin, Leucin, Lysin, Tryptophan und Valin (wobei Arginin und Histidin als sogenannte semiessentielle Aminosäuren gelten).