Reinstes Wasser zeigt eine geringe Leitfähigkeit. Folglich müssen Ionen vorhanden sein. Diese Ionen können nur durch Protonenübertragung zwischen Wassermolekülen entstanden sein. Man spricht von Autoprotolyse. Diese führt auf das Gleichgewicht:
Nach dem Massenwirkungsgesetz gilt daher:
![c(H O+) .c(OH -)
---3-------2---- = K
[c(H2O)]
c(H3O+) .c(OH -) = K .[c(H2O)]2 = Kw](au1x.gif)
Bei 24oC gilt:
![]()
Wegen c(H3O+) = c(OH-) gilt:
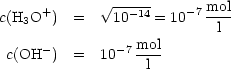
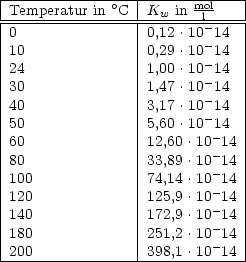
Das Ionenprodukt des Wassers ist temperaturabhängig:
Merke:
Das Ionenprodukt gilt nicht nur für reines Wasser, sondern auch für verdünnte Lösungen von Säuren und Laugen (höchstens einmolare Lösungen). Die Werte von c(H3O+) bewegen sich im allgemeinen zwischen 1 und 10-14.
![+ - -14
+ c(H3O ).c(OH- ) = 10 -14
- log[c(H3O )]+ (- log[c(OH )]) = - log(10 )
- log(10-14) = 14
==> pH + pOH = 14](au6x.gif)
![]()