Chemische Reaktionen laufen unterschiedlich schnell ab. Beispiel für extrem schnell ablaufende Reaktionen:
- Neutralisation:
- Die Wasserbildung bei der Reaktion:
NaOH + HCl -
 Na+Cl- + H2O
Na+Cl- + H2O 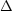 H< 0
H< 0
- Die Bildung von BaSO4 bei der Reaktion
H2SO4 + BaCl2 -
 BaSO4 + 2 HCl
BaSO4 + 2 HCl
- Die Wasserbildung bei der Reaktion:
- Äußerst langsam laufen folgende Reaktionen ab:
- Wasserbildung:
2H2 + O2

 2 H2O
2 H2O
- Das Rosten von Eisen an der Luft:
4Fe + 3O2 -
 2 Fe2O3
2 Fe2O3
- Wasserbildung:
- Langsam ablaufende Reaktionen:
- Alkohol + Carbonsäure -
 Ester + Wasser
Ester + Wasser
- Alkohol + Carbonsäure -
![Reaktionsgeschwindigkeit = umgesetzte-Stoffmenge-[mol]
Zeit
Reaktionsgeschwindigkeit = Zunahme-der Menge-des-Endproduktes
Zeit
Reaktionsgeschwindigkeit = Konzentrations¨anderung-
Zeit
c(t+-Dt)---c(t)
v = Dt
Dc-
v = Dt](gl1x.gif)
![]() Die Reaktionsgeschwindigkeit ist abhängig von der Art der Stoffe.
Die Reaktionsgeschwindigkeit ist abhängig von der Art der Stoffe.
Gleiche Mengen Salzsäure gleicher Konzentration werden mit unterschiedlichen Metallen vermischt. Sie reagieren unterschiedlich schnell.
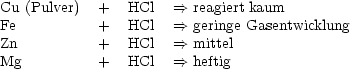
![]() gleiche Mengen, gleiche Konzentration
gleiche Mengen, gleiche Konzentration
![]() gleiche Mengen, unterschiedliche Konzentration
gleiche Mengen, unterschiedliche Konzentration
- Die Reaktionsgeschwindigkeit ist abhängig vom Zerteilungsgrad (Oberfläche) der Reaktionsteilnehmer.
- Bimolekulare Reaktion: 2 A -
 C
C
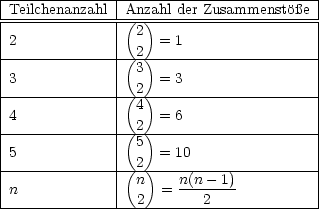
Erklärung:
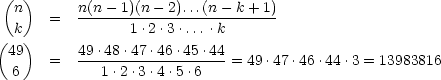
Für große Teilchenzahlen folgt:
![2
v ~ n 2
v ~ [c(A)]
v = k .[c(A)]2](gl10x.gif)
- Trimolekulare Reaktion: 2 A + B -
 C
C
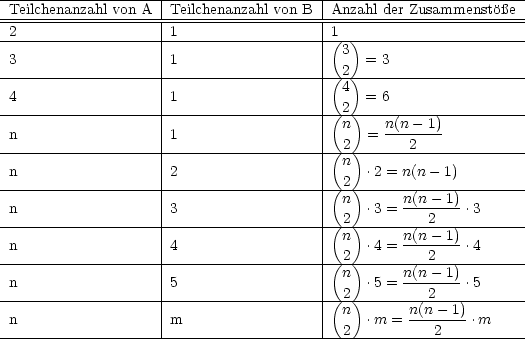
Für große Teilchenzahlen folgt:
![v ~ n2m
v ~ [c(A)]2 .c(B)
2
v = k .[c(A)] .c(B)](gl12x.gif)
- Reaktion vom Typ: 3A + B -
 C
C
Für große Teilchenzahlen folgt:
![v ~ n3m
3
v ~ [c(A)] .c(3B)
v = k .[c(A)] .c(B)](gl13x.gif)
- Reaktion vom Typ: 3A + 2B -
 C
C
Für große Teilchenzahlen folgt:
![v ~ n3m2
3 2
v ~ [c(A)] .c(B)
v = k .[c(A)]3 .c(B)2](gl14x.gif)
3H2 + N2

 2NH3
2NH3
![3
v1 = k1 .[c(H2)] .2c(N2)]
v2 = k2 .[c(NH3)]](gl15x.gif)
Im Gleichgewichtszustand gilt: v1 = v2
![k1[c(H2)]3 .c(N2)]) = k2[(N H3)]2
k [c(NH )]2
-1 = -----33--.c(N2)
k2 [c(H2)]
K = [c(NH3)]2-.c(N2)
[c(H2)]3](gl16x.gif)
Diese Formel stellt das sogenannte Massenwirkungsgesetz dar für diese spezielle Reaktion. Eine umkehrbare Reaktion führt in einem abgeschlossenen System nicht zu einer vollständigen Umsetzung, sondern zu einem Gleichgewicht. Dabei ist es gleichgültig, ob man von den Stoffen der linken oder der rechten Seite der Reaktionsgleichung ausgeht. Die Reaktion kommt äußerlich zum Stillstand bevor die Ausgangsstoffe ganz verbraucht sind. Im Gleichgewichtszustand sind alle am Gesamtvorgang beteiligten Stoffe in einem ganz bestimmten Mengenverhältnis enthalten.
Allgemein gilt:
![n .A+ m .B + l.C + ... <-- --> r.X + s .Y + t.Z + ...
r s t
v2 = k2 .[c(x)] .[c(Y)] .[c(Z)] ....
v1 = k1 .[c(A)]n .[c(B)]m .[c(C)]l ....
-[c(x)]r .[c(Y-)]s .[c(Z)]t ....
K = [c(A)]n .[c(B)]m .[c(C)]l ....](gl17x.gif)
Bei Gleichgewichtsreaktionen besitzt der Quotient aus dem Produkt der Konzentrationspotenzen der Endstoffe und dem Produkt der Konzentrationsprozesse der Ausgangsstoffe im Gleichgewichtszustand bei gegebener Temperatur einen bestimmten für die betreffende Reaktion charakteristischen Wert K, nämlich die Massenwirkungskonstante.
Fe3+ + 3 SCN- ![]()
![]() Fe(SCN)3 (rot)
Fe(SCN)3 (rot)
Bei Erhöhung der Konzentration eines Ausgangsstoffes verschiebt sich das chemische Gleichgewicht zugunsten in Richtung des Endproduktes.
Durch Entfernen eines Endstoffes wird das Gleichgewicht ebenfalls gestört. Aus noch vorhandenen Ausgangsstoffen bilden sich solange Endstoffe bis der Quotient aus den Massenwirkungsprodukten wieder der Gleichgewichtskonstanten entspricht.
Wird auf einem sich im Gleichgewicht befindlichen Systems durch Änderung der äußerem Bedingungen (Temperaturerhöhung/Druckerhöhung) ein Zwang ausgeübt, so verschiebt sich das Gleichgewicht derart, daß es dem Zwang ausweicht. So stellt sich ein Gleichgewicht bei verminderndem Zwang ein.
- 3H2 + N2

 2NH3
2NH3  H = 91
H = 91 
- Fe3+ + 3SCN- -
 Fe(SCN)3
Fe(SCN)3
Eine Erhöhung des Druckes begünstigt die Ammoniakbildung. Aus 4 Raumteilen Ausgangssubstanz entstehen 2 Raumteile des Endproduktes. Eine Temperaturerhöhung begünstigt den Zerfall von Ammoniak.
Allgemein gilt:
Eine Temperaturerhöhung hemmt die exotherme Richtung und eine Temperaturerniedrigung begünstigt diese. Eine Druckerhöhung begünstigt die Reaktionsrichtung, bei der die Stoffe einen geringeren Raumbedarf haben.