Der-Säure-Begriff
1.1 Bezeichnungen
Die Begriffe Säure und Base wurden schon von den Alchimisten benutzt. So
bezeichnet z.B.
- Tachenius (1660):
Säuren sind Stoffe, sie sauren Geschmack besitzen, Kalk aufschäumen und
mit unedlen Metallen unter Gasentwicklung reagieren.Basen nannte er
Stoffe, die mit Säuren Salze bilden.
- Boyle (1663):
Säuren schmecken sauer, färben gewisse Pflanzenstoffe rot, lösen Marmor
(CaCO3) und schneiden aus Na2S2 Schwefel aus. Lösungen, die nicht
sauer, sondern unangenehm scharf und seifig schmecken und beim
Zusammenbringen mit Säuren deren Wirkung aufheben, nannte er
alkalisch.
- Lavoisier (1743-1794):
Beim Lösen von Nichtmetalloxiden in Wasser entstehen Säuren. Beim
Lösen von Metalloxiden in Wasser entstehen Laugen z.B.
- Liebig (1938):
Eine Säure ist eine Substanz, die Wasserstoff enthält, der durch Metalle
ersetzbar ist.
- Arrhenius (1883):
Säuren sind Verbindungen, die in wässriger Lösung H+-Ionen abspalten.
Laugen sind Verbindungen, die in wässriger Lösung OH--Ionen bilden.
Wenn eine Säure mit Wasser reagiert, so gibt sie nach Arrhenius ein Proton (H+) ab
z.B.:

Analog reagiert aber auch Wasser mit Ammoniak:

Das Wassermolekül gibt an Ammoniak ein Proton ab. I.N. Brönsted schlug
daher 1923 eine umfassendere Definition für Säuren und Basen vor, indem er
das OH--Ion als alleiniges basisches Prinzip aufgab. Nach Brönsted gilt:
Säuren sind Stoffe, die Protonen abgeben können (Protonendonatoren,-spender). Laugen
sind Stoffe, die Protonen aufnehmen können (Protonenakzeptoren,-empfänger). Da
jedes Teilchen nach der Protonenabgabe wieder Protonen aufnehmen kann und
umgekehrt, entsteht aus einer Säure durch Abgabe von Protonen eine Base und aus
einer Base durch Aufnahme von Protonen eine Säure.
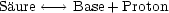
Besteht zwischen einer Säure, eine Base und Protonen ein Gleichgewicht, so
spricht man von einem korrespondierenden Säure-Base-Paar. Der Vorgang der
Protonenabgabe heißt Protolyse. Nach der Definition von Brönsted könne sowohl
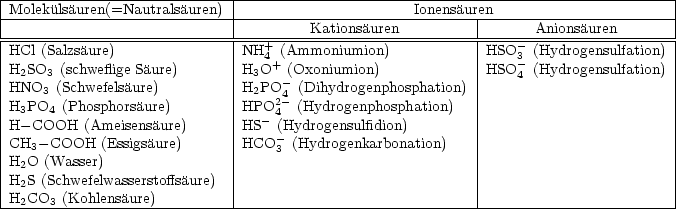
neutrale Teilchen als auch Anionen und Kationen als Säuren bzw. Basen betrachtet
werden. Man unterschiedet daher Neutralsäuren, Aminosäuren und Kationensäuren
bzw. Neutralbasen, Anionenbasen und Kationenbasen!
Stoffe, die sowohl als Säure als auch als Base reagieren können, nennt man amphotere
Stoffe(=Ampholyte). Welche der beiden Reaktionen von diesen Stoffen übernommen
wird, hängt stets vom Reaktionspartner ab.
Je nach Ladung (positiv, negativ oder neutral) der Teilchen, die Protonen abgeben
oder aufnahmen, unterscheidet man:
1.2 Stärke von Säuren und Basen
Eine Säure(Base), die nur ein Proton abgeben (aufnehmen) kann, bezeichnet man als
einprotonig. Um die Stärke von verschiedenen Säuren und Laugen miteinander
vergleichen zu können, betrachtet man ihre Protolysen mit derselben Base(Säure)
H2O.
Allgemein gilt:
1.2.1 Einprotonige Säure HA
Nach dem Massenwirkungsgesetz gilt:
Säuren, die in Wasser gelöst fast vollständig protonisieren, nennt man starke Säuren.
Starke Säuren haben daher große KS-Werte.Definition

Der pKS-Wert ist ein Maß für die Stärke der Säure. Eine Säure ist umso stärker,

1.2.2 Einprotonige Base B
Nach dem Massenwirkungsgesetz:
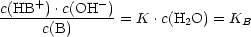
KB heißt Basenkonstante.
Definition:
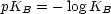
Eine Base ist umso stärker, 
Die Säure- und Basestärke eines korrespondierenden Säure-Base-Paars hängen
miteinander zusammen/sind voneinander abhängig. Eine Säure , die ein
Proton leicht abgibt, korrespondiert mit einer Base, die ein Proton nur schwer
aufnimmt. Das heißt: je stärker die Säure, desto schwächer die korrespondierende
Base.
![K [HA] = c(A--).c(H3O+)-
S c(HA) .c(H2O)](sa15x.gif)
![- c(HB+)-.c(OH--)-
KB[A ] = c(B)](sa17x.gif)
Berechne den KS-Wert einer einmolaren Säure HA, falls diese bei 24oC zu genau
10% dissoziiert ist.
![c(A--).c(H3O+)- 0,1-moll.0,1 moll 1-
KS[HA] = c(HA) = 0,9 mol = 90
l](sa19x.gif)
Für 0,1-normale Essigsäure ist der Aktivitätskoeffizient 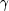 = 0,013 (=1,3%). Berechne
den KS-Wert dieser Säure.
= 0,013 (=1,3%). Berechne
den KS-Wert dieser Säure.
![- + mol mol
KS[Essigs¨aure] = c(A-).c(H3O--) = 0,0013-l-.0,0013--l- ~~ 1,71.10-5
c(HA) 0,0987 moll](sa20x.gif)
Für 0,1-normale Methansäure ist KS = 2, 4 . 10-4. Berechne den Aktivitätskoeffizienten
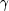 :
:
1.3 Indikatoren
Dies sind Substanzen, mit denen der pH-Wert einer Lösung bestimmt werden kann.
Säure-Base-Indikatoren sind im allgemeinen schwache organische Säuren oder
Laugen, die im undissoziierten Zustand eine andere Farbe (Lichtabsorption) haben
als im dissoziierten Zustand. Der Indikator Methylorange ist eine schwache organische
Säure. Dabei ist das undissoziierte Teilchen (also das Säuremolekül) rot und das
zugehörige Anion (die zugehörige korrespondierende Base oder konjugierte
Base) gelb. Bezeichnet man die Indikatorsäure mit HIn, so läßt sich das
Protolysengleichgewicht des Indikators in wässriger Lösung folgendermaßen
formulieren:

Nach dem Massenwirkungsgesetz gilt:
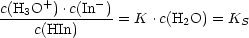
Die Farbe des Indikators ergibt sich aus dem im Gleichgewicht vorliegenden
Verhältnis c(In-): c(HIn), das vom pH-Wert abhängt. Bei einer Erniedrigung des
pH-Wertes (Erhöhung von c(H3O+)) verschiebt sich das Gleichgewicht nach
links und die Lösung nimmt Die Farbe des HIn-Moleküls an. Eine Erhöhung
des pH-Wertes (Erniedrigung von c(H3O+)) bewirkt eine Verschiebung des
Gleichgewichts nach rechts und die Farbe des In--Ions erscheint.
Keine Indikator zeigt jedoch bei einer Änderung von c(H3O+) einen sofortigen
Farbwechsel. Der Farbumschlag vollzieht sich vielmehr innerhalb eines für jeden
Indikator charakteristischen Umschlagbereichs (abhängig von der Farbintensität) des
HIn-Moleküls bzw. In--Ions). Beim Umschlagspunkt des Indikators gilt c(HIn) =
c(In-). Daher ist dann c(H3O+) = 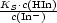 = KS und folglich pH = pKS;HIn
Bedingung für den Umschlagspunkt. Bei diesem pH-Wert zeigt die Lösung eines
zweifarbigen Indikators eine Mischfarbe. Sind etwa 10 mal so viele HIn-Moleküle wie
In--Ionen vorhanden, so ist für das Auge praktisch nur die Farbe der HIn-Moleküle
wahrnehmbar.
= KS und folglich pH = pKS;HIn
Bedingung für den Umschlagspunkt. Bei diesem pH-Wert zeigt die Lösung eines
zweifarbigen Indikators eine Mischfarbe. Sind etwa 10 mal so viele HIn-Moleküle wie
In--Ionen vorhanden, so ist für das Auge praktisch nur die Farbe der HIn-Moleküle
wahrnehmbar.
Ist umgekehrt c(In-) = 10 . c(HIn), so zeigt die Lösung die Farbe der In--Ionen.
Der Umschlagsbereich eines Indikators, in dem man eine Farbänderung erkennt, liegt
also innerhalb von 2 pH-Einheiten: pH = pKS ± 1. Diese Grenzen sind daher
keinesfalls exakt. Sie können durch Lösungsmittel oder Fremdionen beeinflusst
werden. Da unser Auge nicht für alle Farben gleich empfindlich sit, variieren die
Umschlagsintervalle einzelner Indikatoren. Manche Indikatoren besitzen zwei
verschiedene Umschlagbereiche.
Beispiel:
KS[Lackmus] = 10-7. Bei pH < 5 ist Lackmus rot und bei pH > 8 ist
Lackmus blau. Berechne c(In-): c(HIn) für diese pH-Werte.
Die Lösung erscheint daher rot, falls c(In-) : c(HIn) = 1 : 100.
Die Mischung erscheint blau, falls 10 mal so viele In--Ionen vorhanden sind
als HIn-Moleküle. Der Umschlagsbereich von Lackmus beträgt folglich 3
pH-Einheiten. Der KS-Wert von Phenolphthalein beträgt etwa 10-9. In welchem
Konzentrationsverhältnis liegen bei pH=7 die farblosen und die roten Teilchen
vor?
Das Verhältnis c(In-) : c(HIn) beträgt 1 : 100.
1.4 Pufferlösungen
Als Puffergemische bezeichnet man Lösungen, deren pH-Wert sich bei Zusatz von
wenig Säure oder wenig Lauge praktisch nicht oder nur unwesentlich ändert. In der
Regel enthalten Puffergemische eine schwache (organische) Säure HA und die
zugehörige konjugierte Base A- (in Form des völlig dissoziierten Alkalisalzes von
HA) im Molverhältnis 1 : 1 (oder eine schwache Base und die zugehörige konjugierte
Säure im Molverhältnis 1 : 1).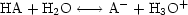
Nach dem Massenwirkungsgesetz gilt:

Und daher folgt:
Enthält ein Puffergemisch die Säure HA und die konjugierte Base A- im
Molverhältnis 1 : 1, so gilt:
Das heißt, der pH-Wert, bei dem ein äquimolekulares Gemisch aus HA und A-
puffert, ist gleich dem pKS-Wert der Säure.
Beispiel:
Acetatpuffer (äquimolekulare Mischung aus Essigsäure und
Na-Acetat)

- Bei Zugabe
von wenig Säure (z.B. HCl) werden die zugegebenen H3O+-Ionen durch
die im Puffergemisch reichlich vorhandenen Acetationen abgefangen. Es
bildet sich nach der Gleichung CH3-COO- + H3O+

 CH3COOH +
H2O solange undissoziierte Essigsäure und Wasser, bis der Wert K der
Gleichgewichtskonstanten wieder erreicht ist.
CH3COOH +
H2O solange undissoziierte Essigsäure und Wasser, bis der Wert K der
Gleichgewichtskonstanten wieder erreicht ist.
- Bei Zugabe von wenig Lauge bilden die OH--Ionen mit den H3O+-Ionen
Wasser. Im gleichen Umfang wie die H3O+-Ionen dabei verbraucht werden,
dissoziiert Essigsäure solange, bis der Wert K wieder erreicht ist.
In beiden Fällen ändert sich c(H3O+) praktisch nur unwesentlich, so daß der
pH-Wert bei Zugabe von wenig Säure bzw. Lauge gleich bleibt.
1.4.1 Wichtige Puffergemische
Zu 10 ml einmolarem Acetatpuffer und zu 10 ml Wasser werden jeweils 1 ml
einmolare HCl hinzugegeben. Berechne jeweils den pH-Wert dieser Mischung.
- 10 ml Acetatpuffer enthalten 0,01 mol Essigsäuremoleküle und 0,01 mol
Acetationen (1 l Acetatpuffer
 1 mol).
1 mol).
- 1 ml einmolare HCl enthält 0,001 mol H3O+-Ionen.
Wenn man beides zusammengibt entstehen 11 ml Gemisch.
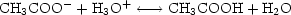
Es bilden sich 0,001 mol Essigsäure. In den 11 ml Mischung sind daher 0,01 + 0,001
= 0,011 mol Essigsäure enthalten.
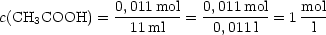
Die Mischung enthält außerdem 0,01-0,001 = 0,009 mol Acetationen.
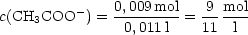
Blut ist gepuffert mit mehreren Puffergemischen, damit die bei Stoffwechselvorgängen
auftretenden Säuren und Basen unwirksam gemacht werden können.
Weitere Hilfen für die pH-Regulation:
- Man spricht von Acidose, falls pHBlut < 7, 37!
- Man spricht von Alkalose, falls pHBlut > 7, 43!
Säuren können gepuffert werden durch alls Salze aus schwachen Säuren mit starken
Basen. Basen können gepuffert werden durch Salze aus starken Säuren mit schwachen
Basen.
![|---------------------------|------------------------------------|
|Molek¨ulbasen(=Nautralbasen)-|-------------Ionenbasen--------------|
-------------------------------Kationbasen---------Anionbasen------
|NH---(Ammoniak)-------------|[Al(OH)(H--O)-]2+-|-OH--(Hydroxidion)--|
|H O3 (Wasser) | 2 5 | NO -(Nitration) |
| 2 | | SO23- (Sulfition) |
| | | SO32- (Sulfation) |
| | | 42- |
| | | CO33- (Karbonation) |
| | | PO2-4 (Phosphation) |
-----------------------------------------------S--(Sulfidion)-------](sa5x.gif)
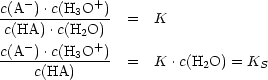
![- + -
Ks[HA] .KB[A-] = c(A--).c(H3O--) .c(HA)-.c(OH--)-= c(H3O+) .c(OH -) = 10- 14
c(HA) c(A-)
logKs[HA] + logKB[A-] = log10-14 = - 14
logKs(HA]- logKB[A-] = +14
pKs[HA] + pKB[A-] = 14](sa18x.gif)
![- + 2
KS[H -COOH] = c(H-COO---).c(H3O--) = --x----= 2,4.10-4
c(H -COOH) 0,1- x
x1 ~~ 4,78.10-3
[x2 ~~ - 5,02 .10-3 < 0]](sa21x.gif)





![+ c(HA)--
c(H3O ) = KS . c(A -)
[c(HA) ]
- log[c(H3O+)] = - log KS - log c(A--)-
[ ]
pH = pKS - log c(HA)-
[ A - ]
c(A--)
pH = pKS + log c(HA)](sa33x.gif)

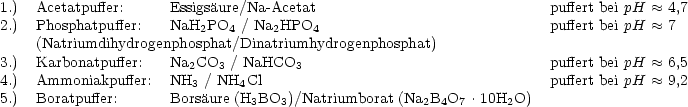
![c(CH3COO -).c(H3O+)
-----c(CH--COOH)------ = KS
3
c(H3O+) = KS .c(CH3COOH)---
c(CH3COO [- ) ]
+ c(CH3COOH)--
- log(c(H3O )) = - logKS - log c(CH3COO -)
[c(CH3COO -)]
pH = pKS + log c(CH--COOH)-
[ ] 3
= 4,76+ log -9
11
= 4,76+ log9- log11
~~ 4,67](sa41x.gif)
