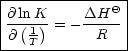Wir gehen von folgender allgemeiner chemischer Reaktion aus:
| Wie ist das Massenwirkungsgesetz thermodynamisch zu formulieren? |
Es gilt:
Für konstantes p und T erhalten wir dann:
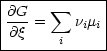
Wir vergleiche mit
![]() G
G![]() = -RT lnK
und erhalten daraus:
= -RT lnK
und erhalten daraus:
ai sind hier die zuvor definierten Aktivitäten.
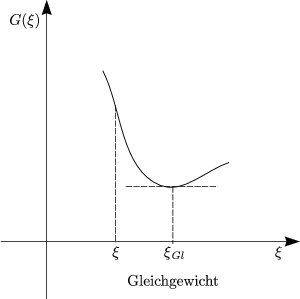
![]() G < 0 strebt einem Minimum zu: dn1 = ni - ni
G < 0 strebt einem Minimum zu: dn1 = ni - ni![]() = d
= d![]() . Im Gleichgewicht
gilt:
. Im Gleichgewicht
gilt:
Auch hier seien T und p konstant:
Für eine ideale Mischung gilt ![]() i =
i = ![]() i
i![]() + RT lnxi, wie wir zuvor bewiesen
haben. Für eine reale Mischung lassen sich die chemischen Potentiale mit den
Aktivitätskoeffizienten
+ RT lnxi, wie wir zuvor bewiesen
haben. Für eine reale Mischung lassen sich die chemischen Potentiale mit den
Aktivitätskoeffizienten ![]() i schreiben als
i schreiben als ![]() i =
i = ![]() i
i![]() + RT lnxi + RT ln
+ RT lnxi + RT ln![]() i =
i = ![]() i
i![]() + RT lnai.
Durch Einsetzen resultiert:
+ RT lnai.
Durch Einsetzen resultiert:
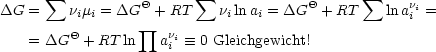 | (4.1) |
läßt sich dies auch schreiben als:
Man kann somit K aus rein thermodynamischen Funktionen ![]() G
G![]() ausrechnen.
ausrechnen.
CaCO3 (s) ![]() CaO (s) + CO2
CaO (s) + CO2 ![]()
Es gilt ai = 1 bei reinen festen Stoffen.
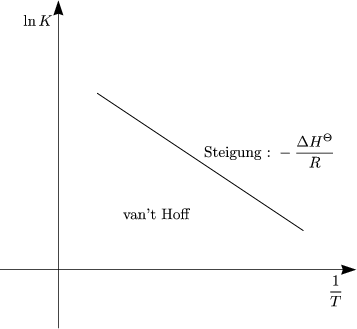
Dies gilt nach GIBBS-HELMHOLTZ. Des weiteren benötigen wir folgenden mathematischen Zusammenhang:
Damit läßt sich folgende sehr wichtige Beziehung finden: