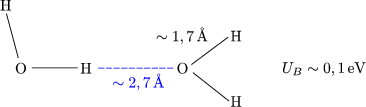
Diese besitzt aufgrund der Beteiligung des Wasserstoffs eine Sonderstellung. Es handelt sich um einen Zwitter zwischen ionischer und kovalenter Bindung. Die Ionisationsenergie des Wasserstoff ist groß; sie beträgt 13,6eV. Es gibt sein Elektron infolgedessen nur ungern ab im Vergleich zu F, O, etc. Hat es das Elektron jedoch abgegeben, so ist das entstandene „Ion“ sehr klein.

Die Wasserstoffbrücken-Bindung ist meistens unsymmetrisch.