3.1 Gleichgewichtskriterien
Wiederholung:
- 1.Hautpsatz: dU = dq + dw
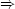 Energieänderung im System
Energieänderung im System
- 2.Hautpsatz:
 S > 0 in einem isolierten System
S > 0 in einem isolierten System  Richtungsaussagen
Richtungsaussagen
Tatsache:
- Zustandsänderung (z.B. bei einer
chemischen Reaktion) sind mit Energieänderung verknüpft (z.B.
 q < 0
(exotherm) bzw.
q < 0
(exotherm) bzw.  q > 0 (endotherm))
q > 0 (endotherm))
- Richtungsänderung
Fazit:
Um Zustandsänderungen allgemein zu beschreiben, suchen wir Zustandsfunktionen,
die Aussage über Energie plus Entropie beinhalten.
Vorbetrachtung:
- Wir wollen die Aussagen (1) und (2) zusammenfassen in eine Aussage für
das Extremalverhalten einer Funktion.
- Aussagen auf System allein konzentrieren
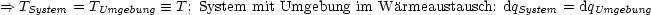
 | (3.1) |
Nach dem 1. und 2.Hautpsatz gilt also: