Wir betrachten einen Wärmeaustausch bei V = const. und gehen aus von
dS -![]() > 0 und dem 1.Hautpsatz dU = dq - pdV
> 0 und dem 1.Hautpsatz dU = dq - pdV ![]() dq, wobei pdV
dq, wobei pdV ![]() 0
gilt.
0
gilt.
Wir multiplizieren auf beiden Seiten mit -T und erhalten:
Wir fassen den Term auf der linken Seite als Differential zusammen:
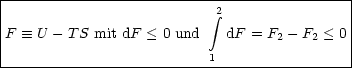
Wir betrachten einen Wärmeaustausch bei p = const.:
Auch hier multiplizieren wir mit -T, womit sich dH - TdS < 0 ergibt. Wenn T = const. gilt, folgt daraus d(H - TS) < 0. Wir erhalten damit
G = G(p,T) = HTS als Zustandsfunktion mit dG < 0.
Da U eine Zustandsfunktion ist, kann man sie als totales Differential schreiben:
Daraus folgt nun durch Vergleichen:
Da U eine Zustandsfunktion ist, läßt sich außerdem der Schwarz’sche Satz anwenden:
Wir haben hier eine der sogenannten MAXWELL-Relationen hergeleitet. Zu U(V,T)
![]() thermodynamische Zustandsgleichung:
thermodynamische Zustandsgleichung:
Betrachten wir die Mastergleichung für F:
Das totale Differential von F lautet:
Wir führen einen Koeffizientenvergleich mit der Mastergleichung durch:
Wir erhalten somit wieder eine der MAXWELLschen Relationen:
Betrachten wir G ![]() H - TS.
H - TS.
|
| (3.2) |
Der Koeffizientenvergleich ergibt:
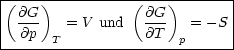
Daraus erhalten wir erneut:
Aus dG < 0 folgt G2 - G1 < 0. Im Gleichgewicht gilt dG = 0.
Wir veranschaulichen dies graphisch folgendermaßen:
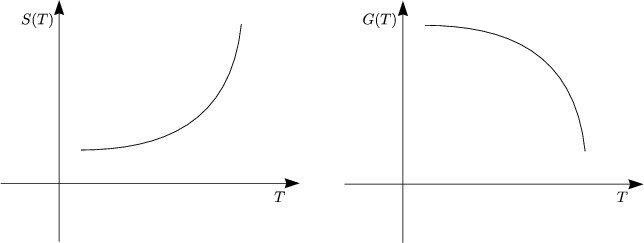
Aus G = H - TS folgt:
Wir betrachten:
Es gilt hier also folgender Zusammenhang:
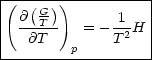
Beispielsweise gilt für chemische Reaktionen ![]() G = G2 - G1:
G = G2 - G1:
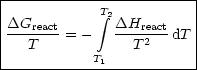
Diesen Ausdruck nennt man Gibbs-Helmholtz-Beziehung.
Hier gilt:
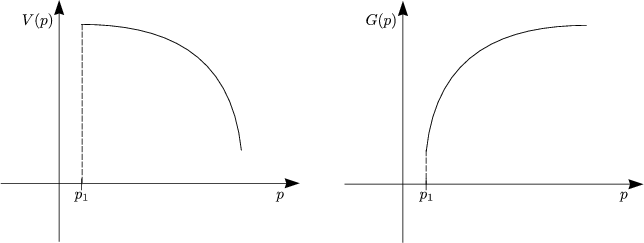
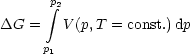
Wir setzen die Kenntnis der Zustandsgleichung unseres Systems p = p(V,T) bzw. V = V (p,T) voraus. Beispielsweise ist für Festkörper oder Flüssigkeiten V schwach p-abhängig:
Andererseits gilt für ein ideales Gas die Gasgleichung pV = nRT, woraus folgt:
Als Standardzustand wird der Zustand bei p = 1atm bezeichnet: