| Unter welchen Bedingungen herrscht thermodynamisches Gleichgewicht zwischen zwei Phasen ( |
| Im Gleichgewicht ist dG = 0 und dn( |
Daraus ergibt sich dG:
Es gilt also ![]()
![]() =
= ![]()
![]() , T
, T![]() = T
= T![]() und p
und p![]() = p
= p![]() . Das Gleichgewicht zweier Phasen
(
. Das Gleichgewicht zweier Phasen
(![]() ) und (
) und (![]() ) setzt Gleichheit der intensiven thermodynamischen Variablen
voraus.
) setzt Gleichheit der intensiven thermodynamischen Variablen
voraus.
| Wie sehen die Phasengrenzkurven (Koexistenzkurven) für einfache Phasengleichgewichte (Clapeyron-Gleichung) aus und auch speziell dann, wenn die Phasengleichung durch eine Zustandsgleichung beschrieben wird? |

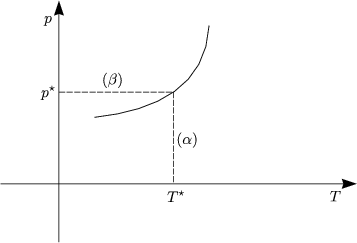
Es seien p = p(V,T), V = V (p,T) gegeben. Wie sieht p(T) mit V =const. aus? Wie
sieht außerdem die Verknüpfung mit ![]() S,
S, ![]() V beim Phasenübergang aus? Zu Lösung
dieses Problems gehen wir von der Gleichgewichtsbedingung
V beim Phasenübergang aus? Zu Lösung
dieses Problems gehen wir von der Gleichgewichtsbedingung ![]() (
(![]() ) =
) = ![]() (
(![]() ) aus. Es muß
nun gelten:
) aus. Es muß
nun gelten:
Im Gleichgewicht gilt nach Voraussetzung d![]() (
(![]() ) = d
) = d![]() (
(![]() ):
):
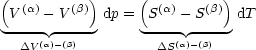
Wir erhalten die CLAPEYRONsche Gleichung:


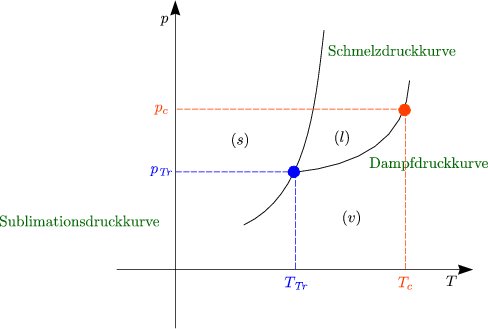
Im allgemeinen gilt ![]() V > 0 mit Ausnahme von H2O, Bismut, etc., wobei
V > 0 mit Ausnahme von H2O, Bismut, etc., wobei
![]() S jedoch immer > 0 ist.
S jedoch immer > 0 ist.
Im Gleichgewicht gilt ![]() S =
S = ![]() Da bei Verdampfung
Da bei Verdampfung ![]() Hv immer> 0
ist, gilt außerdem
Hv immer> 0
ist, gilt außerdem ![]() V l
V l![]() v »
v » ![]() V s
V s![]() l. Da außerdem
l. Da außerdem
ist die Dampfdruckkurve flacher als die Schmelzdruckkurve.
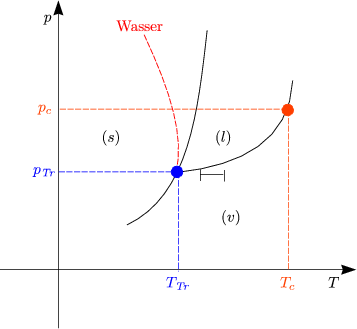
Wenn ![]() H(T) und
H(T) und ![]() V (T) bekannt sind, läßt sich das ganze integrieren:
V (T) bekannt sind, läßt sich das ganze integrieren:
Betrachten wir hier den Grenzfall V m(v) » V (l), was beispielsweise bei idealen Gasen gilt. Deshalb nähern wir V m(T) mit dem idealem Gasgesetz an:
Des weiteren nehmen wir an, daß ![]() H innerhalb des Integrationsbereichs konstant
ist. Daraus folgt nun die CLAUSIUS-CLAPEYRONsche Gleichung:
H innerhalb des Integrationsbereichs konstant
ist. Daraus folgt nun die CLAUSIUS-CLAPEYRONsche Gleichung:
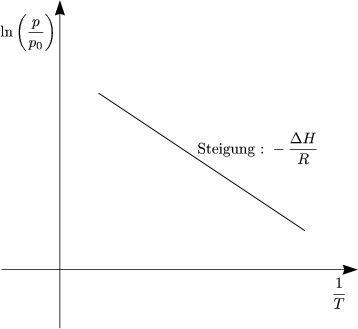
Wenn man ln![]() gegen T aufträgt, erhält man eine Gerade mit der Steigung
-
gegen T aufträgt, erhält man eine Gerade mit der Steigung
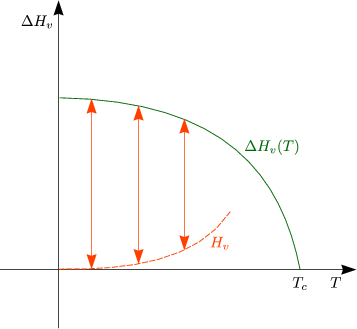
-![]() . Die Kritik am CLAUSIUS-Diagramm ist die Annahme, daß
. Die Kritik am CLAUSIUS-Diagramm ist die Annahme, daß ![]() H unabhängig
von T ist, was aber oft nicht der Fall ist.
H unabhängig
von T ist, was aber oft nicht der Fall ist.