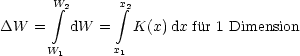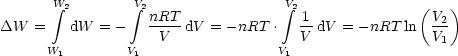2.1 Innere Energie und 1.Hauptsatz der Thermodynamik
Frage:
|
| |
| Was ist die Problemstellung der Thermodynamik? |
| |
|
| |
Antwort:
|
| |
| Befaßt sich mit der Beschreibung der physikalischen und chemischen Eigenschaften der makroskopischen
Materie (eines thermodynamischen Systems) im thermodynamischen Gleichgewicht. |
| |
|
| |
- Physikalische Eigenschaften:
- Temperatur
- Druck
- Wärmeleitfähigkeit
- Dichte
- Chemische Eigenschaften:
Wichtig ist hier zum Beispiel NH3-Synthese:
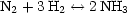
Frage: Bei welchem Druck und bei welcher Temperatur entsteht wieviel
NH3?
- Thermodynamisches System:
Ausschnitt der Materie unter bestimmten Randbedingungen?
- Isoliertes System: Konstantes V , T, N
- Abgeschlossenes System: Konstantes V , N

- Offenes System: Teilchen- und Energieaustausch mit Umgebung
zugelassen

Qualitatives Kriterium:
Die physikalisch-chemischen Eigenschaften sind T-unabhängig. Quantitative Kriterien
werden wir später durchnehmen. Thermodynamische Größen bzw. Variablen sind p,
V , T, n, .... In der Thermodynamik von zentralem Interesse sind energetische
Größen, wie beispielsweise die innere Energie U(T,V ).
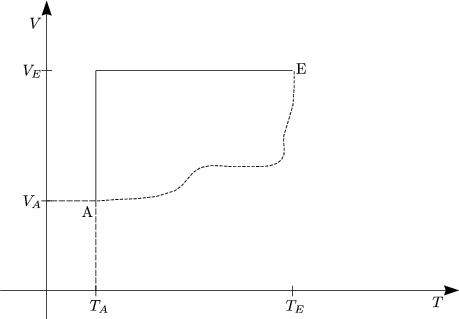
Bildchen: z.B. Gas aus N2-Molekeln:
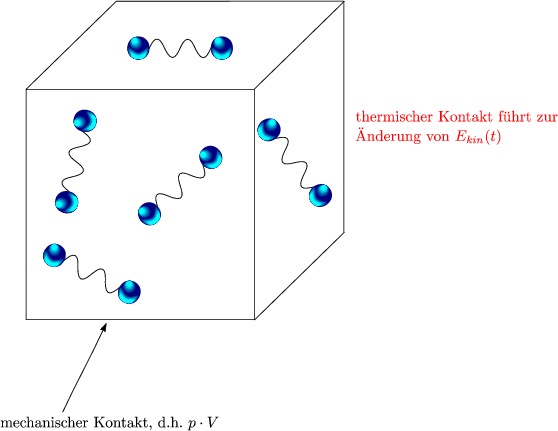
Eine Volumenänderung (von außen) führt hierbei zu einer Änderung von Epot, also
der potentiellen Energie der Molekeln.
Zusammenfassung:
Man kann innere Energie U(V,T)
- durch thermischen Kontakt
- durch mechanischen Kontakt
ändern.
1.Hauptsatz der Thermodynamik (Erfahrungssatz):
|
| |
| dU = dq + dw |
1.Formulierung: dq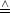 Wärmeänderung; dw Wärmeänderung; dw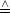 Arbeit Arbeit |
| |
Speziell für ein isoliertes System gilt: dq = dw = 0 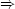 dU = 0 dU = 0 |
2.Formulierung: 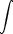 dU = const.
dU = const. |
| |
|
| |
Hierbei gilt folgende Vorzeichenkonvention:
- dq, dw > 0: Positiv für System
- dV > 0: Endotherme Prozesse
Analog gilt umgekehrt:
- dq, dw < 0: Negativ für System
- dV < 0: Exotherme Prozesse
Frage:
|
| |
| Was bedeutet Arbeit in der Thermodynamik? |
| |
|
| |
Mechanik:
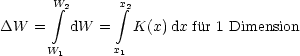
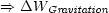
Hierdurch ändern sich die Abstände R zwischen den Molekeln nicht, oder
mit anderen Worten: U bleibt unverändert. Diese Form der Arbeit ist also
thermodynamisch uninteressant. Nur, wenn V geändert wird, erfolgt eine Änderung
in innerer Energie. Folglich ist nur die pV -Arbeit (Druck-Volumenarbeit) als einzigste
interessant.
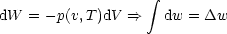
Da nur Gleichgewichtssysteme von Interesse sind, muß p = p(V,T) aus
Zustandsgleichung eingesetzt werden, wie beispielsweise die pV -Arbeit bei der
Expansion eines verdünnten Gases (T=const., isotherme Expansion).
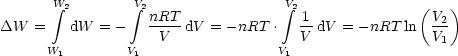
Wärmeaustausch dq?
Die Erfahrung zeigt, daß die Temperatur eines
thermodynamischen Systems ansteigt, wenn dq > 0 zugeführt wird.
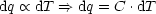
In diesem Zusammenhang läßt sich die spezifische Wärme definieren als:
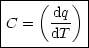
- C hängt ab von Stoffmenge, d.h. Cm
- Es macht einen Unterschied, ob dq bei V =const. oder p=const. zugeführt
wird. Bei p=const. kann Teil von dq zu pV -Arbeit umgewandelt werden.
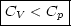
Wir führen eine genaue Berechnung von CV durch:

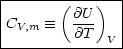
Wir fragen uns, wie groß die Wärmezufuhr bei p=const. ist. Dabei gehen wir vom
1.Hauptsatz aus und führen eine Integration durch:
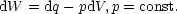
Durch Integration ergibt sich:
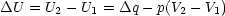
Wir sortieren entsprechend um:
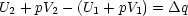
Damit führt eine Wärmeänderung  q also zu:
q also zu:
- Änderung der inneren Energie:
 U
U
- Änderung des Druckes, Volumens:
 (p,V )
(p,V )
Die Größe U + pV  H(p,T) heißt Enthalpie und ist von besonderem Interesse für
die Chemie.
H(p,T) heißt Enthalpie und ist von besonderem Interesse für
die Chemie.
Wiederholung: 1.Hauptsatz der Thermodynamik für innere Energie U = U(V,T):
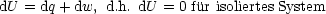

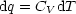
Wir führen die Enthalpie H ein mit H = H(p,T)  U + pV .
U + pV .
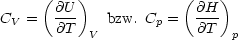
U,H sind extensive thermische Größen, wobei T,p intensive thermische
Variablen sind. Weiterhin ist es sehr wichtig zu wissen, daß U = U(V,T) oder
H = H(p,T) Zustandsfunktionen sind, d.h. dU läßt sich also totales Differential
schreiben.