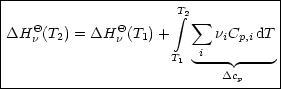Die Thermochemie befaßt sich mit Zustandsänderungen, genauer der Energieänderungen bei chemischen Reaktionen, wie beispielsweise:
In den meisten Fällen laufen diese Reaktionen bei konstantem Druck ab.
Die interessante energetische Zustandsfunktion ist H = H(T,p). Wir wissen bereits
nach dem 1.Hauptsatz, daß sich U,H nicht absolut angebbar sind, sondern nur
Änderungen ![]() U,
U,![]() H. Infolgedessen gibt es Konventionen für Festlegung der
jeweiligen „Nullpunke“ bzw. Standards.
H. Infolgedessen gibt es Konventionen für Festlegung der
jeweiligen „Nullpunke“ bzw. Standards.
![]() Hc ist die bei vollständiger Verbrennung von Kohlenwasserstoffen zu
CO2 (g) und H2O (l) freiwerdende Enthalpie, wie man bei der folgenden
Reaktionsgleichung sieht:
Hc ist die bei vollständiger Verbrennung von Kohlenwasserstoffen zu
CO2 (g) und H2O (l) freiwerdende Enthalpie, wie man bei der folgenden
Reaktionsgleichung sieht:
H(p,T) ist eine Zustandsfunktion. Wir betrachten die allgemeine chemische Reaktion:
| Bekannt sei |
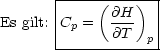
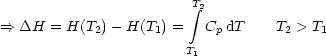
Analog gilt für ![]() H, wobei wir ausgehen von:
H, wobei wir ausgehen von:
Wir leiten partiell nach der Temperatur ab und erhalten unter Verwendung der Gleichung für die Wärmekapazität Cp:
Die Umkehrabbildung der Differentiation ist die Integration, die angewandt
auf obige Gleichung ![]() H
H![]()
![]() ergibt. Wir erhalten somit folgende wichtige
Aussage:
ergibt. Wir erhalten somit folgende wichtige
Aussage: