Gegeben sei ein isoliertes System (GAS, FLÜSSIGKEIT, FESTKÖRPER), d.h. die Gesamtenergie E des Systems ist konstant. Des weiteren sei das System zusammengesetzt aus Molekeln.

| Wie verteilen sich NA Molekeln auf die molekularen Energiezustände, so daß E resultiert bei Energieaustausch zwischen den Molekeln? |
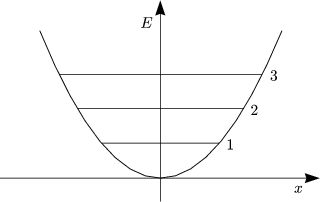
Beispielsweise gäbe es einen Energiefreiheitsgrad: ![]() vib = h
vib = h![]()
![]() . Gegeben sei die
makroskopische Energie E Es stellt sich nun die Frage, wieviele Molekeln Ni die
Energie
. Gegeben sei die
makroskopische Energie E Es stellt sich nun die Frage, wieviele Molekeln Ni die
Energie ![]() i haben.
i haben.
Unter Nebenbedingung:
| Welche Verteilungen der 3 Molekeln auf die erlaubten Energiezustände |
| Welche Verteilungen der Molekeln (3) auf |
Die Annahme ist, daß Molekeln unterscheidbar seien: (a,b,c).
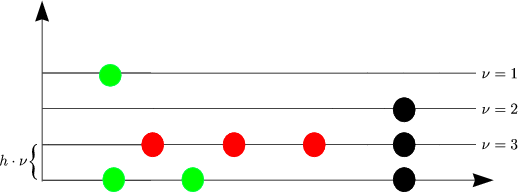
Verallgemeinerung auf NA Molekeln: Die Anzahl der Möglichkeiten, NA verschiedene
Objekte auf ![]() i zu verteilen, ist NA!. Wenn in einem
i zu verteilen, ist NA!. Wenn in einem ![]() i (Kasten) ni Molekeln sitzen,
gilt:
i (Kasten) ni Molekeln sitzen,
gilt:
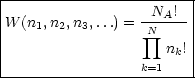
| Was ist die wahrscheinlichste Verteilung? Diejenige, bei der W als Funktion von Ni war! |
Lösung: ______ Extremwertaufgaben mit mehreren Variablen n1, n2, n3, n4, ..., ni
| Was bedeutet die Konstante vor der Exponentialfunktion bzw. die Konstante |
![]() hat die Dimension von 1/Energie; genauer gilt
hat die Dimension von 1/Energie; genauer gilt ![]() =
= ![]() .
.
Die Nebenbedingung ist, daß die Summe aller Molekeln ni die Gesamtzahl der Molekeln ergeben muß:
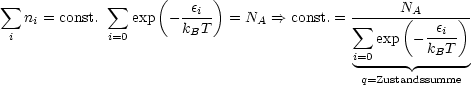

Man kann p(![]() i) nun folgendermaßen interpretieren:
i) nun folgendermaßen interpretieren:
| Welchen Beitrag liefern diese beiden Energiefreiheitsgrade zu CV ? |
| Wir müssen Um(V,T) berechnen. |
Wir berechnen nun die innere Energie mittels der uns bereits bekannten Beziehungen:
Daraus ergeben sich:
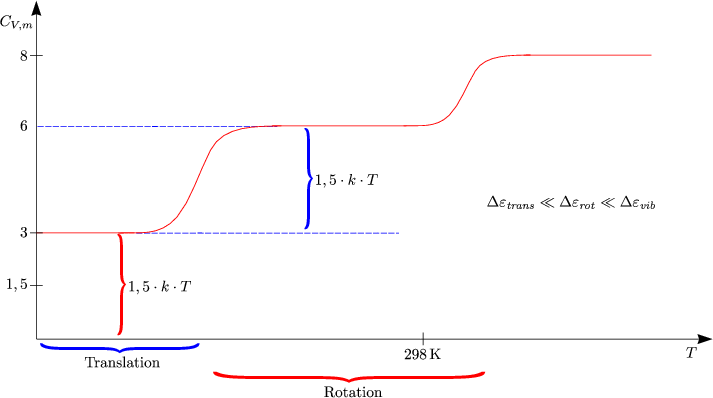
Diskussion von U(V,T) und CV (T):
Das wesentliche Ergebnis ist also, daß bei T »![]() Gleichverteilung vorliegt (klassischer
Grenzfall).
Gleichverteilung vorliegt (klassischer
Grenzfall).
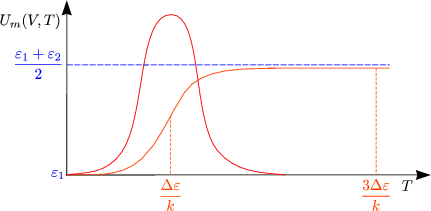
| Spezifische Wärme von Gasen ausrechnen in dem Grenzfall der klassischen Gleichverteilung |
3 Energiefreiheitsgrade der Translation mit ![]() kT pro
Translationsfreiheitsgrad
kT pro
Translationsfreiheitsgrad
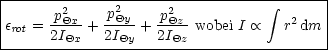
3 Energiefreiheitsgrade der Rotation mit ![]() kT pro
Translationsfreiheitsgrad
kT pro
Translationsfreiheitsgrad

| Wieviel Schwingungsfreiheitsgrade hat eine Molekel aus n Atomen (nichtlineare Molekel)? |
Betrachten wir zuvor als Beispiel eine nichtlineares Molekel, welche aus drei Atomen besteht:
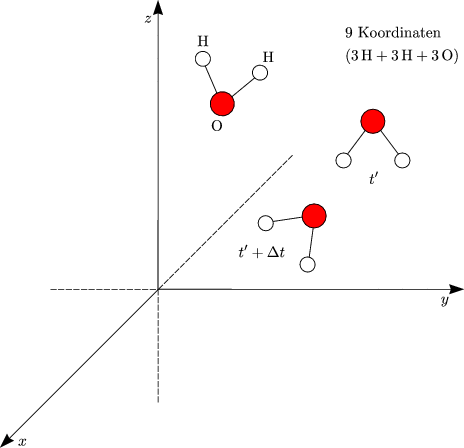
Gehe ins Schwerpunktskoordinatensystem:
Allgemein gilt:
Eine nichtlineare Molekel besitzt (3n - 6) Vibrationsfreiheitsgrade.
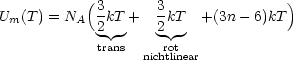
Dagegen besitzen lineare Molekeln 3 Translationsfreiheitsgrade, 2 Rotationsfreiheitsgrade und (3n - 5) Vibrationsfreiheitsgrade.