Stromerzeugung ist mglich, wenn positive von negativen Ladungen getrennt worden sind.

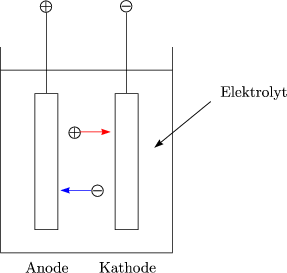
Ein Elektrolyt ist ein Stoff, der geschmolzen oder in wriger Lsung in Ionen dissoziiert wird.
Geladenes Atom/Molekl ( Wandernde)
Betrachten wir folgende Vorgnge, die sich in einem Elektrolyten abspielen knnen:
Bei Anlegen eines elektrischen Feldes bewegen sich die Ionen in einem Elektrolyt entlang der elektrischen Feldlinien. Fr die Wanderungsgeschwindigkeiten v+ der Kationen und v- der Anionen gilt hierbei folgender Zusammenhang:
E ist die elektrische Feldstrke und b die Beweglichkeit.
Fr die Beweglichkeiten anderer Ionen gilt:
Fr die Stromdichte j± der Ionen folgt:
Die gesamte Stromdichte ergibt sich additiv aus den Stromdichten der Kationen j+ und der Anionen j-:
Damit folgt dann fr den Strom durch einen Elektrolyten:
Es liegt also ein OHMsches Verhalten vor.
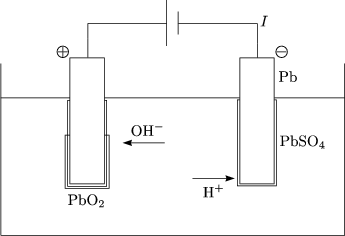
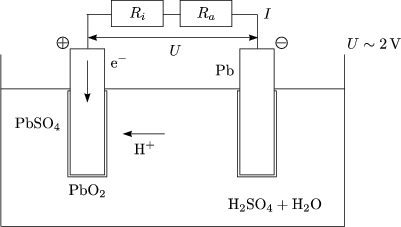
Abscheidung der Ionen an den Elektrolyten, Zersetzung der Elektroden
Hier findet Reduktion (Elektronenaufnahme) statt:
Hier haben wir Oxidation (Elektronenabgabe):
Ein Mol eines Ions der Ladung zIon . e transportiert die Ladung Q = NA . zIon . e = F . eIon.
Wieviel Kupfer wird bei I = 1A pro Sekunde abgeschieden?
1mol Kupfer besitzt eine Masse von 63,5g.
Damit berechnet sich dann die transportierte Ladung mittels der FARADAYkonstante nach der obigen Formel:
Damit ergibt sich also die abgeschiedene Menge an Kupfer:
Stoffaustausch zwischen Elektrode und Elektrolyt durch Diffusion
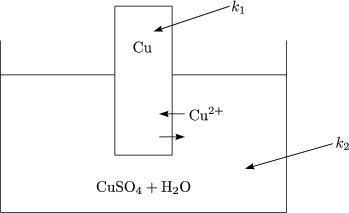
Wir wrden erwarten, da dieser Stoffaustausch so lange stattfindet, wie k1![]() k2
ist. Mehr Ionen verlassen Elektrode als in sie eintreten. Es entsteht dabei eine
sogenannte elektrochemische Doppelschicht.
k2
ist. Mehr Ionen verlassen Elektrode als in sie eintreten. Es entsteht dabei eine
sogenannte elektrochemische Doppelschicht.
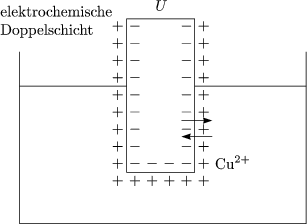
Das Aufladen der Elektrode bremst den Zuflu der Ionen. Es entsteht ein Gleichgewicht, das sich mittels der BOLTZMANNformel berechnet:
Im Fall von Cu und Cu++ findet eine Aufladung der Elektrode auf U = 0,34V gegenber dem Elektrolyt statt. Bei Zn und Zn++ ldt sich die Elektrode auf U = -0,76V auf, da W(Metall) < W(Lsung).
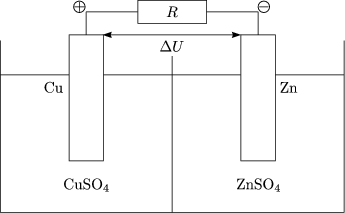
In 1 mol Ionen pro Liter wriger Lsung ergibt sich:
| Material | U [V] |
| Li | -3,02 |
| Na | -2,71 |
| Zn | -0,76 |
| Pb | -0,13 |
| Pt | 0 |
| Cu | +0,34 |
| Ag | +0,80 |
| Au | +1,50 |
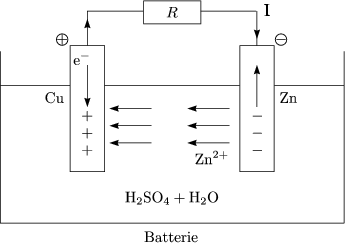
Dies geht so lange, bis die Kupfer-Elektrode von Zink umgeben ist. Daher:
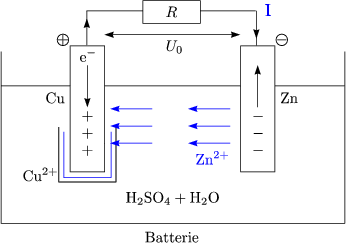
Der Proze ist genau dann beendet, wenn das CuSO4 verbraucht ist.
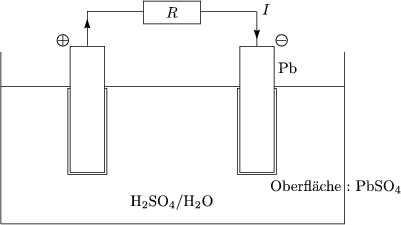
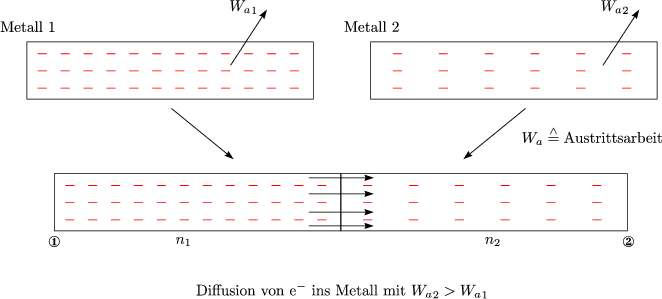
Es fliet so lange Ladung, bis sich ein Gleichgewicht ausgedrckt durch die BOLTZMANNverteilung (eigentlich Fermiverteilung) eingestellt hat:
Im Gleichgewicht besteht eine Potentialdifferenz, die sich mit der Ablsearbeit Wa schreiben lt als:
Damit folgt:

Fr T1 = T2 gilt:
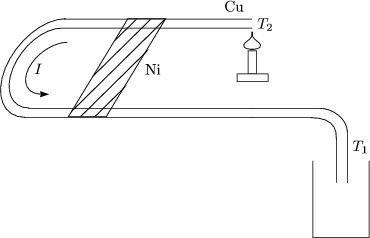
Eine mgliche Anwendung des Effekts liegt in der Temperaturmessung.

Es sei T1 > T2.
Dies geht solange, bis ![]() T = 50oC. Der Peltiereffekt wird dazu verwendet,
elektrischen Gerte zu khlen.
T = 50oC. Der Peltiereffekt wird dazu verwendet,
elektrischen Gerte zu khlen.