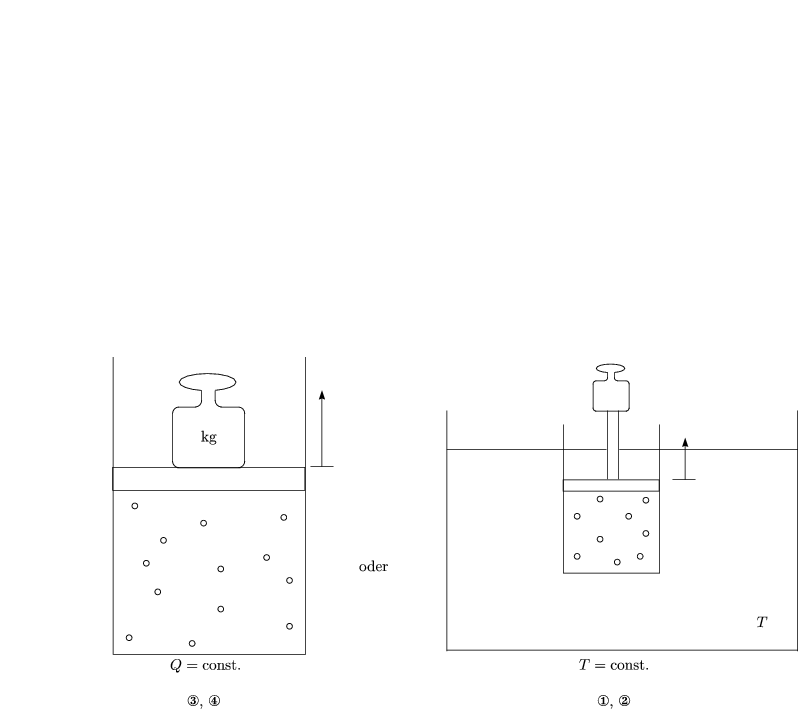

Wir betrachten vier Grenzfälle:

Dies folgt nach dem 2.Hautpsatz. Durch Integration folgt:

Mit der Zustandsgleichung des idealen Gases pV = nRT ergibt sich:

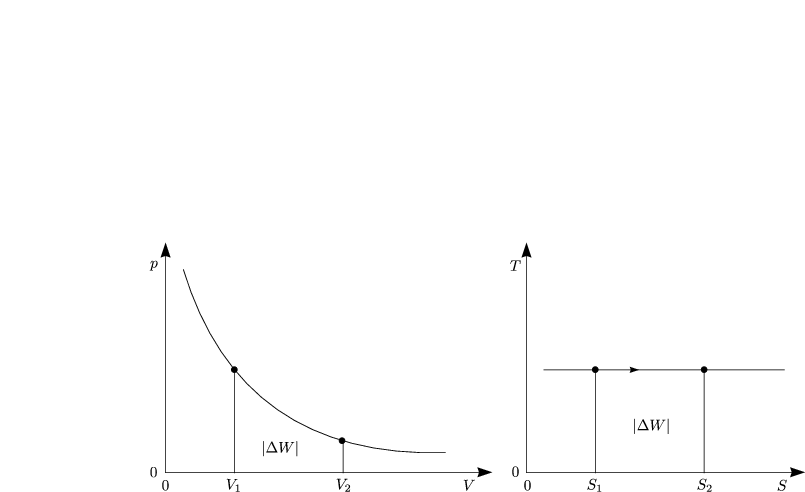
Für V 2 > V 1, d.h. für Expansion des Gases, gilt ![]() W < 0, das Gas leistet
also Arbeit.
W < 0, das Gas leistet
also Arbeit.


Diese Energie kommt aus dem Wärmebad, das dafür sorgt, daß die
Temperatur des Gases konstant ist. Das Gas hat also nur die Rolle eines
Vermittlers. Seine innere Energie ist ![]() nRT = const. bleibt unverändert, nur
seine Entropie steigt an. Das ist grundverschieden von der Expansion einer
Hookeschen Feder, bei der eben die Energie, die das Gewicht gewonnen hat im
Schwerefeld der Erde, aus der Feder kommt.
nRT = const. bleibt unverändert, nur
seine Entropie steigt an. Das ist grundverschieden von der Expansion einer
Hookeschen Feder, bei der eben die Energie, die das Gewicht gewonnen hat im
Schwerefeld der Erde, aus der Feder kommt.
Wir nehmen an, daß das Gewicht beispielsweise plötzlich weggerissen wird. Dann ist die Kraft gleich 0 und damit auch die zu leistende Arbeit.
Wir vom ersten Hauptsatz zu erwarten war. Mit dU = ![]() W +
W + ![]() Q folgt:
Q folgt:

Siehe 2.
Mit dU = ![]() nRT =
nRT = ![]() W +
W + ![]() Q folgt:
Q folgt:
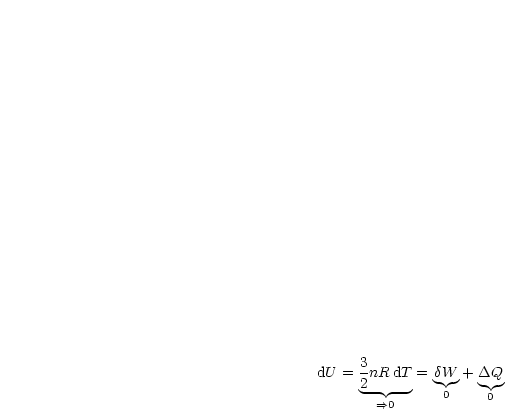
Wir halten zuvor noch eine Kleinigkeit fest:

Mit der Zustandsgleichung des idealen Gases pV = nRT folgt:
Durch Integration von Anfangs- bis Endzustand resultiert:
Daraus ergibt sich nun durch exponieren:

Hieraus folgt offensichtlich:
Der Exponent ![]() ist gleich
ist gleich ![]() - 1. Nun setzen wir nochmals die ideale
Gasgleichung ein:
- 1. Nun setzen wir nochmals die ideale
Gasgleichung ein:
Wir fassen dies in folgender Form zusammen:
Dies ist die sogenannte Adiabatengleichung des idealen Gases.
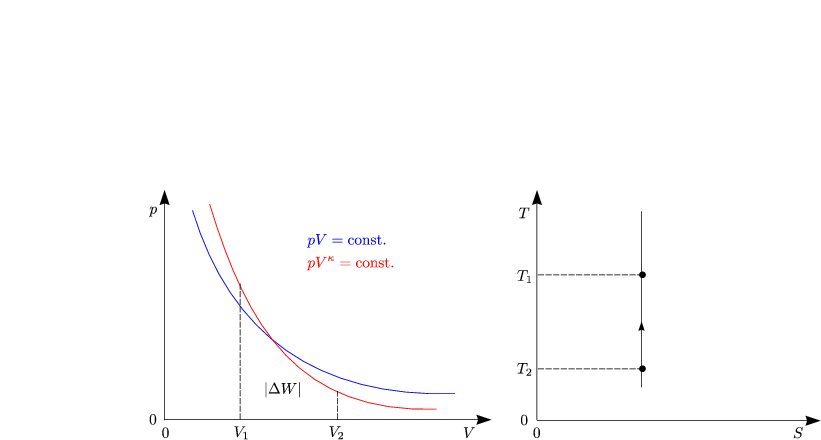
Damit folgt die Arbeit:
In diesem Fall kommt die Energie, die der geleisteten Arbeit entspricht, es kühlt sich ab. Seine Entropie bleibt konstant.
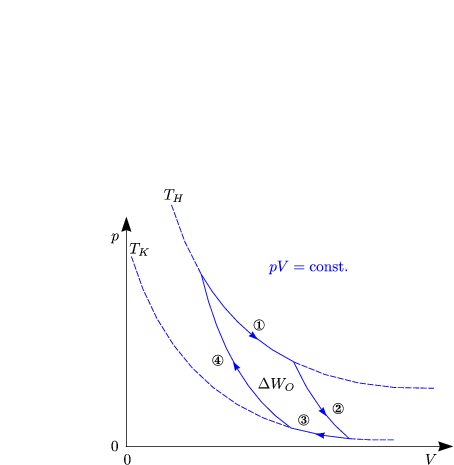
Technisch relevante Maschinen verwenden Kreisprozesse, d.h. nach einen Arbeitszyklus nimmt die Maschine wieder den gleichen thermodynamischen Zustand an. Interessant ist folgendes:
Dieses Prinzip wird beispielsweise in Motoren, Wärmepumpen, Kühlschränken usw.
benutzt. Der 1.Hautpsatz verbietet unmittelbar periodisch arbeitende Maschinen, die
nichts tun, als mechanische Arbeit zu liefern. Wegen dU = 0 nach einem Zyklus und
mit ![]() Q = 0 ergibt sich:
Q = 0 ergibt sich:
Eine solche Maschine nennt man Perpetuum Mobile 1.Art.

Der erste Hauptsatz alleine verbietet jedoch nicht ein Perpetuum Mobile 2.Art. Dies
ist eine periodisch arbeitende Maschine, die nicht tut als ein Wärmebad abzukühlen
und mechanische Arbeit zu leisten (dU = 0 = ![]() Q +
Q + ![]() W).
W).
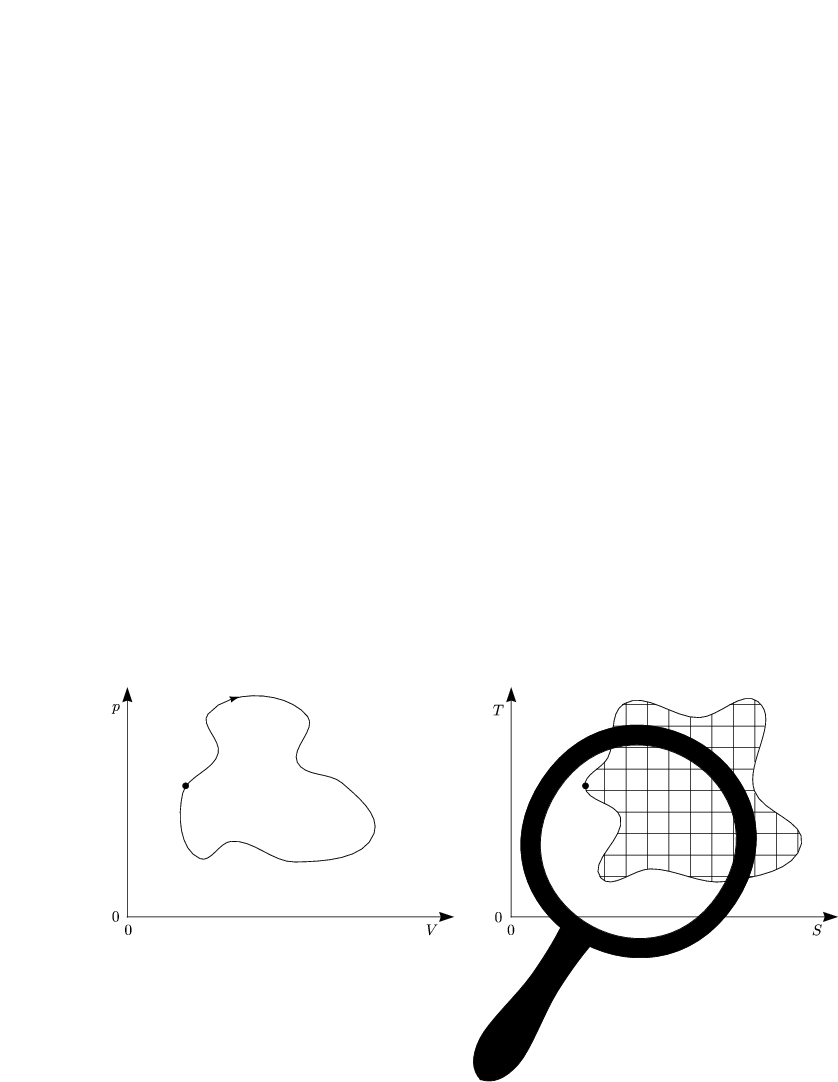
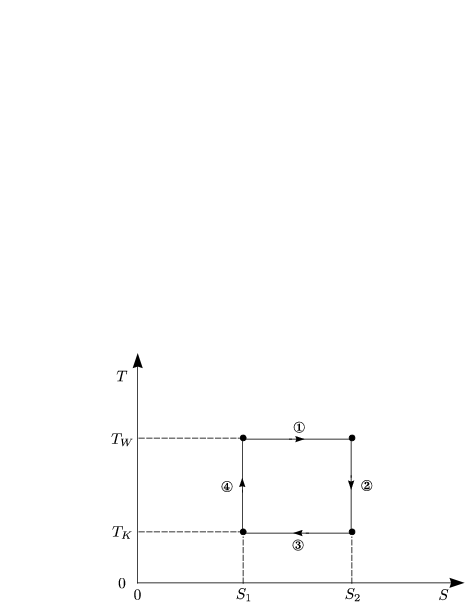
Die Arbeitssubstanz kann ein ideales Gas sein - muß aber kein ideales Gas sein. Für einen Zyklus gilt:
Damit ergibt sich, da ![]() Q bei adiabatischen Prozessen 0 ist:
Q bei adiabatischen Prozessen 0 ist:
Die im Schritt 1 geleistete mechanische Arbeit kommt aus dem heißen Wärmebad mit Temperatur TH. Wir konvertieren jedoch wieder mechanische Arbeit in Wärme in Schritt 3, das Wärmebad mit der Temperatur TK wird aufgeheizt (außer, falls TK = 0). Wärme wird damit im allgemeinen nicht vollständig in mechanische Arbeit umgewandelt. Wie groß ist der Wirkungsgrad?
Dies ist der sogenannte Wirkungsgrad. Mit ![]() QH = TH
QH = TH![]() > 0 ergibt sich der
Wirkungsgrad
> 0 ergibt sich der
Wirkungsgrad ![]() des Carnotschen Kreisprozesses bei reversibler Prozeßführung:
des Carnotschen Kreisprozesses bei reversibler Prozeßführung:
Bei reversibler Prozeßführung gilt:
Mit dem Wirkungsgrad ![]() folgt:
folgt:
Mit ![]() QHirrev <
QHirrev < ![]() QHrev > 0 folgt, daß der Bruch
QHrev > 0 folgt, daß der Bruch ![]() dem Betrage nach größer
wird bei irreversibler Prozeßführung. Mit
dem Betrage nach größer
wird bei irreversibler Prozeßführung. Mit ![]() QKirrev <
QKirrev < ![]() QKrev < 0 ergibt sich
dann noch, daß der Bruch
QKrev < 0 ergibt sich
dann noch, daß der Bruch ![]() bei irreversibler Prozeßführung negativer
wird:
bei irreversibler Prozeßführung negativer
wird:
Dies ist der Wirkungsgrad des Carnotschen Kreisprozesses bei beliebiger
Prozeßführung. Wählt man nur ein Wärmebad, d.h. TH = TK, folgt daraus, daß
![]() = 0 ist. Es ist also nicht möglich, eine periodisch arbeitende Maschine zu bauen,
die nichts tut als ein Wärmebad abzukühlen und mechanische Arbeit zu
leisten, obwohl dies dem Energieerhaltungssatz überhaupt nicht widersprechen
würde.
= 0 ist. Es ist also nicht möglich, eine periodisch arbeitende Maschine zu bauen,
die nichts tut als ein Wärmebad abzukühlen und mechanische Arbeit zu
leisten, obwohl dies dem Energieerhaltungssatz überhaupt nicht widersprechen
würde.

Dies ist eine Folge des 2.Hauptsatzes (und des 1.Hauptsatzes).
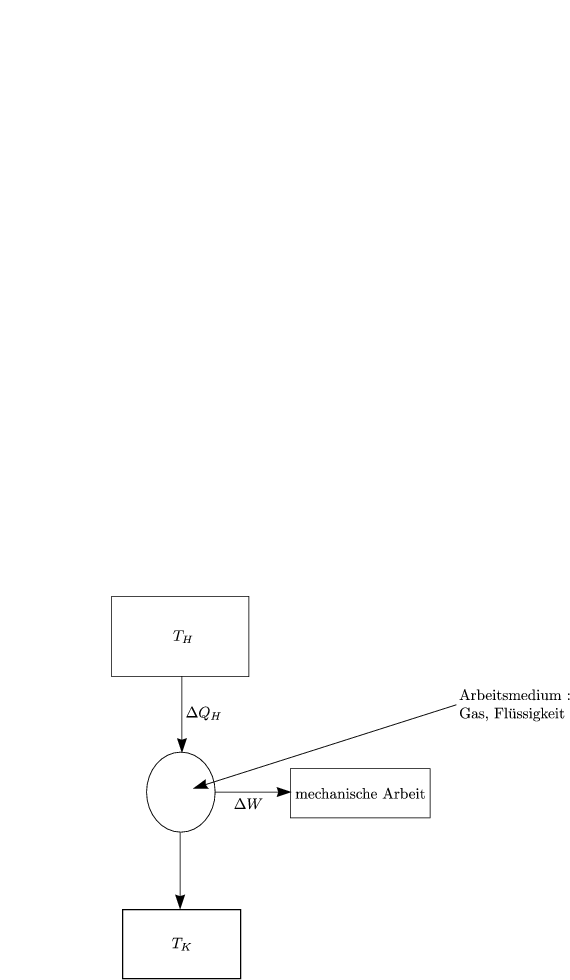
Die Arbeitssubstanz sei ein ideales Gas.