Im Gegensatz zum idealen Gas wollen wir jetzt die Wechselwirkung der Gasmoleküle
explizit berücksichtigen. Wir idealisieren die Gasmoleküle als Kugeln mit Radius r
und Querschnitt ![]() =
= ![]() r2 (
r2 (![]() Wirkungsquerschnitt):
Wirkungsquerschnitt):
![]()
Bewegt sich ein Molekül um die Strecke l, hat es ein Volumen l . ![]() überstrichen
(falls r « l). Dann folgt die Zahl der Moleküle in diesem Volumen mittels
Dreisatz:
überstrichen
(falls r « l). Dann folgt die Zahl der Moleküle in diesem Volumen mittels
Dreisatz:
Wird diese Zahl ![]() 1, so findet im Mittel ein Stoß statt. Damit folgt die mittlere freie
Weglänge:
1, so findet im Mittel ein Stoß statt. Damit folgt die mittlere freie
Weglänge:

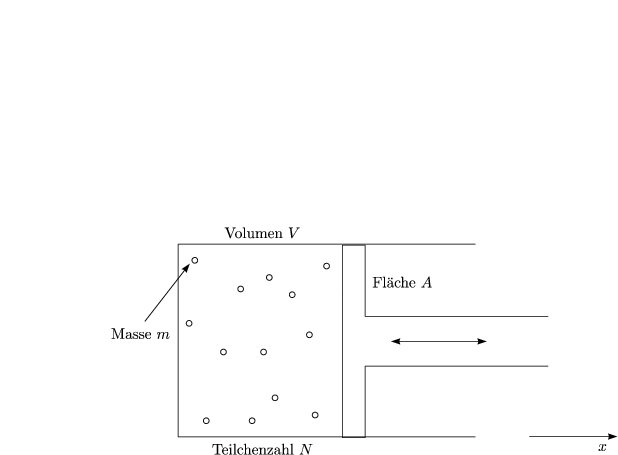
Wieder betrachten wir ein Zeitintervall dt. Wir groß ist der Kraftstoß Fx dt auf den Stempel? Haben die Teilchen beispielsweise den Impuls pi,x, so gilt:
Der Faktor 2 rührt vom Impulserhaltungssatz her, da das Teilchen beim Stoß ja die Richtung ändert. Die Wechselwirkung hat zwei Effekte:
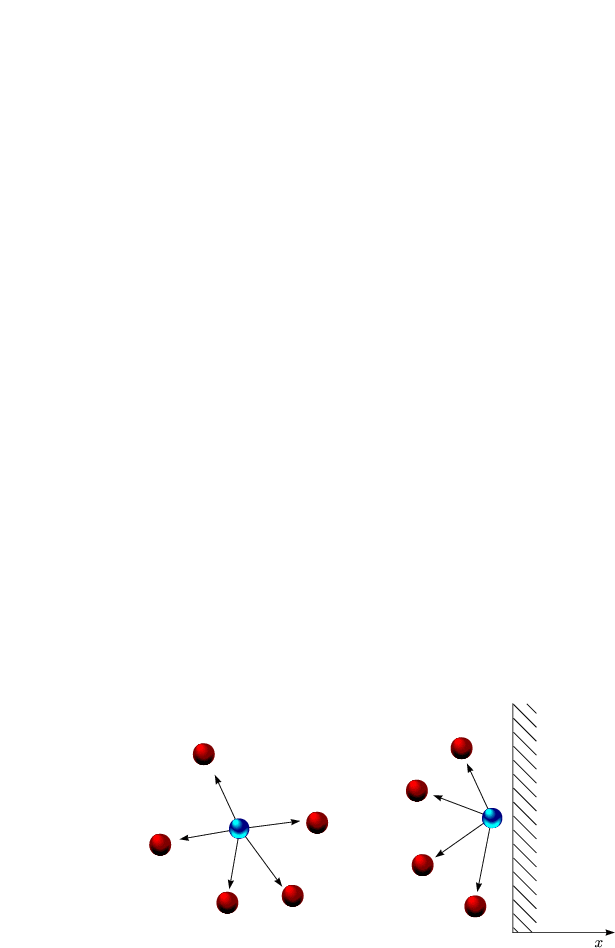
Die Dicke des Randes sei d. Dann wirkt die Kraft:
![]() ist eine Proportionalitätskonstante, die materialspezifisch ist. Das
Molekül ist für eine bestimmte Zeit
ist eine Proportionalitätskonstante, die materialspezifisch ist. Das
Molekül ist für eine bestimmte Zeit ![]() in dieser Randzone. Somit
reduziert sich sein Impuls und man erhält:
in dieser Randzone. Somit
reduziert sich sein Impuls und man erhält:
Der Faktor ![]() kommt daher, weil sich die eine Hälfte der Teilchen nach
links und die andere nach rechts bewegt.
kommt daher, weil sich die eine Hälfte der Teilchen nach
links und die andere nach rechts bewegt.
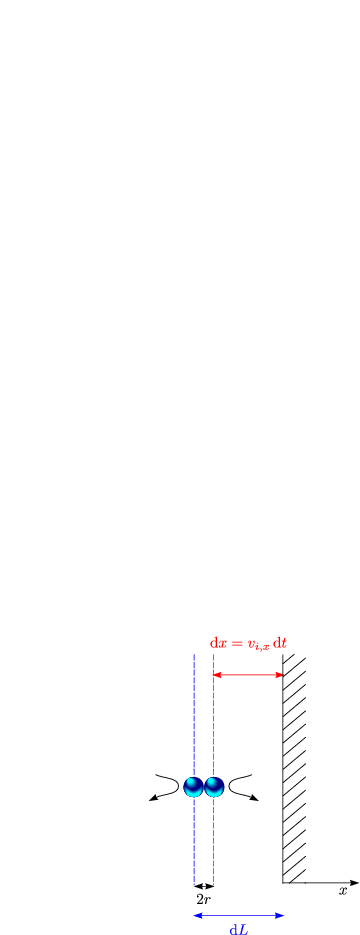
Ohne Stöße würde ein Molekül im Zeitintervall dt die Strecke dx
zurücklegen. Für einen zentralen Stoß entlang der x-Achse zweier Teilchen
mit entgegengesetztem Impuls verlängert sich die Strecke effektiv auf
dx + 2r.
Im Mittel erfährt das Molekül auf einer freien Weglänge l einen Stoß; es
gilt also folgendes:
Für beliebige Stöße reduziert sich dies nun um einen Faktor ![]() < 1:
< 1:
Also folgt damit:
Damit wird:

Die Effekte 1 und 2 führen also nun durch Einsetzen von II und III und I zu:
Somit wird der Druck pi = ![]() :
:
Summation über alle Impuls pi,x ergibt:
Der zweite und vierte Term hängen nicht mehr vom Summationsindex i ab. Wir können diese somit von der Summe abspalten und erhalten:
![]() und
und ![]() sind Zahlenwerte, die eine sehr kleine Größenordnung besitzen.
Infolgedessen kann der Term proportional zu d .
sind Zahlenwerte, die eine sehr kleine Größenordnung besitzen.
Infolgedessen kann der Term proportional zu d . ![]() .
. ![]() « 1 vernachlässigt werden,
wobei dann folgt:
« 1 vernachlässigt werden,
wobei dann folgt:
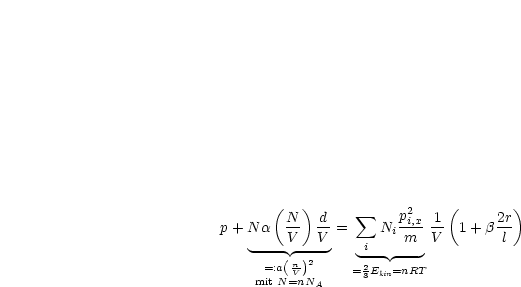
Weiterhin gilt für kleine x:
Damit ergibt sich:
Mittels dieser Beziehung folgt nun:
Wir schreiben nun:
Damit folgt das Endergebnis:

Dies ist die sogenannte Van-der-Waals-Gleichung oder auch die Zustandsgleichung
realer Gase. Der Term a![]() 2 wird häufig als Binnendruck bezeichnet. nb ist das
sogenannte Kovolumen. Mit a = b = 0 erhalten wir wieder:
2 wird häufig als Binnendruck bezeichnet. nb ist das
sogenannte Kovolumen. Mit a = b = 0 erhalten wir wieder:
Also folgt hier die Zustandsgleichung idealer Gase.
Wir integrieren diesen Ausdruck:
Die innere Energie ist somit eine Funktion der Temperatur und des Volumens. Mit a = 0 folgt natürlich wieder die innere Energie des idealen Gases: