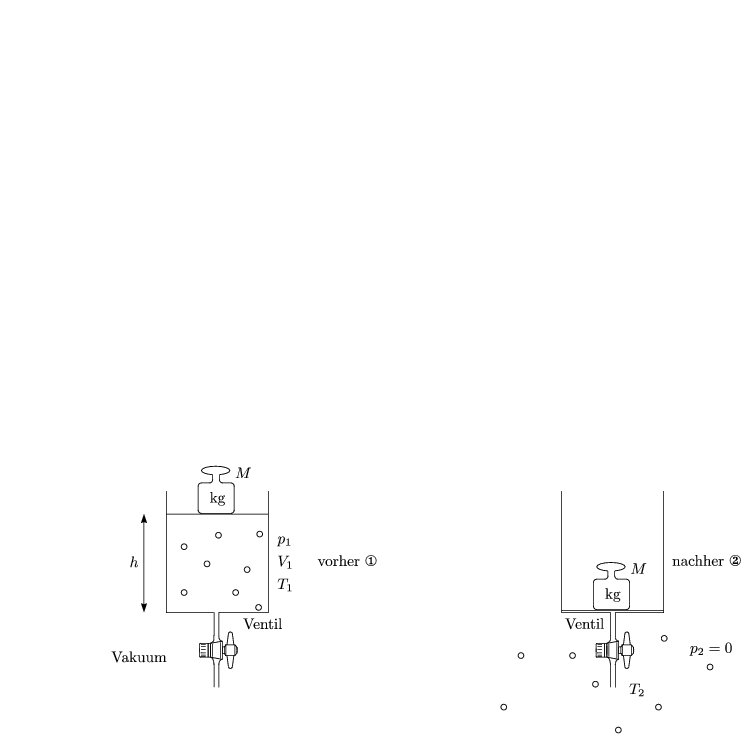
Wir betrachten die irreversible adiabatische Expansion realer Gase.

Die Enthalpie bleibt bei diesem Vorgang konstant:
Die innere Energie U des Gases ist somit nicht erhalten, aber die Enthalpie H = U + pV ist erhalten. Die Enthalpie des realen Gases lautet (Kapitel 5.1):
Außerdem benötigen wir die Zustandsgleichung realer Gase:
Wir lösen nach p auf:
Damit drücken wir die Enthalpie durch T und V aus:
Eigentlich gilt T = T(p,S) und V = V (p,S). Durch Bildung des totalen Differentials ergibt sich:
Wir lösen nach dT auf:

Einsetzen ergibt:
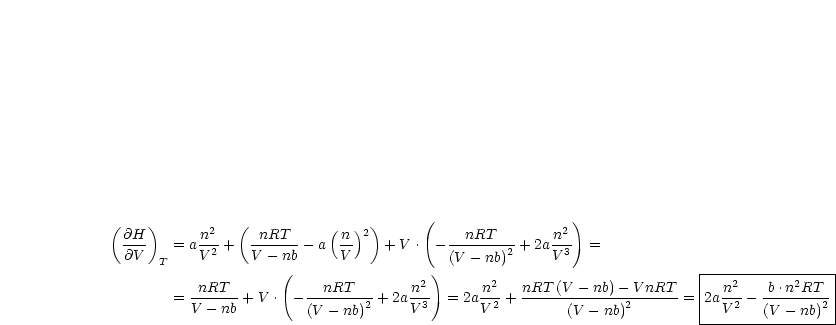 | (11.3) |
Damit resultiert dann für den Bruch:

Der Zähler kann negativ werden für T < Ti. Ti ist die sogenannte Inversionstemperatur. Für Ti ergibt sich:
Da nb « V , ergibt sich schließlich:
Unterhalb der Inversionstemperatur Ti kühlt sich das reale Gas ab, oberhalb erwärmt es sich. Diesen Effekt, den Joule-Thomson-Effekt nutzt man zur Verflüssigung von Gasen. Für ideale Gase folgt:
Damit ist also dT = 0, d.h. die Temperatur des idealen Gases bleibt unverändert.
