Wir wollen in diesem Kapitel herausfinden, was die Ursache für die Struktur und für physikalische Eigenschaften (insbesondere metallisch bzw isolierend) ist. Die Idee ist nun, Elektronenwellenfunktionen der Atome zu betrachten (Ne - Na (3s-Elektron)). Wir wollen die Bindungsarten zuerst in Gruppen einteilen:
Warum kollabiert der Festkörper nicht infolge der Coulombabsto▀ung der Kerne? Diese ist zu schwach! Die Ursache dafür ist das Pauli-Prinzip. Bei Annäherung der Atome findet eine Überlappung der Elektronenwellenfunktionen statt.
Hier liegt dann ein kovalenter Bindungsanteil vor.
Hier ist ein Übertritt nur in höhere Zustände möglich. Dies führt zur Absto▀ung der Atome, welche wir als harte Kugeln betrachten.
Das absto▀ende Potential kann durch folgende Näherung beschrieben werden:
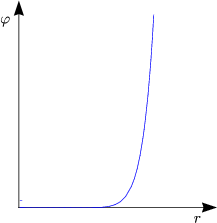
Wichtig ist die hohe Potenz in r. Oft verwendet man auch folgende Näherung:
Dieses bezeichnet man dann als Born-Mayer-Potential.
Die Bindungsenergie oder Gitterenergie allgemein ist abhängig vom Bindungstyp und der Zahl der nächsten Nachbarn. Es handelt sich um die Differenz zwischen der Energie der freien Atome (Ionen) im Grundzustand (also ohne kinetische Energie) und der Atome (Ionen) im Festkörper unter Berücksichtigung der Nullpunktsenergie (Teilchen im Potentialtopf). Typische Zahlenwerte für Bindungsenergien sind:
| Element | K | Be | B | C | N | O | F | Ne |
| | 1,6 | 3,3 | 5,8 | 7,4 | 4,9 | 2,6 | 0,8 | 0,02 |
| | | | ||||||