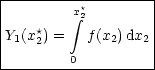
| Wir betrachten eine homogene Phase aus K Komponenten. Wie setzen sich die molaren thermodynamischen Größen dieses Systems aus den Beiträgen der einzelnen Komponenten zusammen? |
Wir betrachten eine Mischung aus C6H6 (l) + C6H5CH3 (l). Wir nehmen an, daß es sich um eine ideale Mischung handelt, das heißt, daß die Wechselwirkungen 1 : 1,1 : 2,2 : 2 gleich sein sollen.

Wir betrachten wiederum eine ideale Mischung, der welcher also die Wechselwirkungen
1-1, 1-2, 2-2 gleich sein sollen. Des weiteren sei vorausgesetzt, daß ![]() 1-1,
1-1,![]() 1-2,
1-2,![]() 2-2
äquivalent seien.
2-2
äquivalent seien.
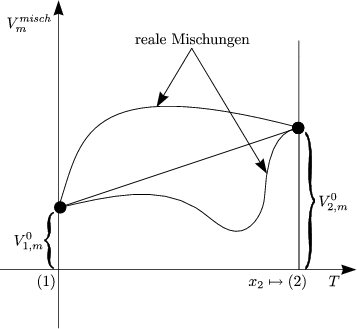
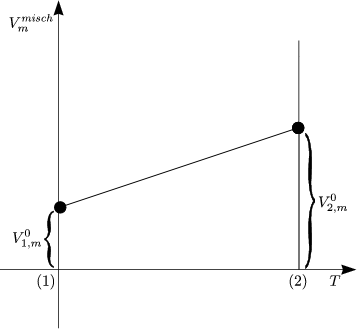
In realen Mischungen können die extensiven Mischungsgrößen Y m![]() V m, Gm, Fm,
Sm, Hm, Um, ... von idealen Werten abweichen.
V m, Gm, Fm,
Sm, Hm, Um, ... von idealen Werten abweichen.
| Wie ist Y m aus Einzelbeiträgen der Komponenten darstellbar, speziell für binäres System aus (1) und (2)? |
Da p und T konstant sind, fallen die ersten beiden Ausdrücke weg:
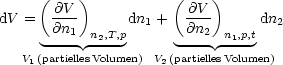
Daraus ergibt sich also mit den partiellen Volumina V 1 und V 2:
| Mischungsgrößen sind allgemein aus den partiellen Größen Y m = |
| Wie ist Y i aus der integralen Größe Y m zu bestimmen? |
Der Beweis ist einfach, aber länglich!
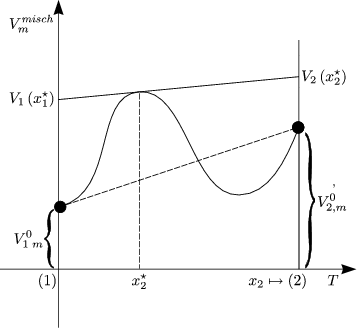
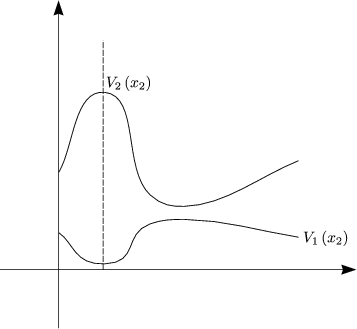
| Sind V 1(x2) und V 2(x2) (siehe Bild) linear unabhängig? |
| Nein! Die Antwort gibt die GIBBS-DUHEMsche Gleichung. |
Y ist eine Zustandsfunktion, also kann man auch schreiben:
Wir bilden die Grenzwerte: