Wobei ![]() beispielsweise für V m definiert ist als:
beispielsweise für V m definiert ist als:
Wie groß ist nun ![]() S zum Beispiel für zwei ideale Gase?
S zum Beispiel für zwei ideale Gase?
Wir gehen vom 1. und 2. Hauptsatz aus:
Wie wir schon in Kapitel 2 gesehen haben, ist für ein ideales Gas dU = 0.
Durch Integration erhalten wir:
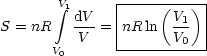
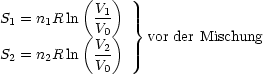
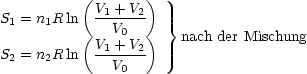
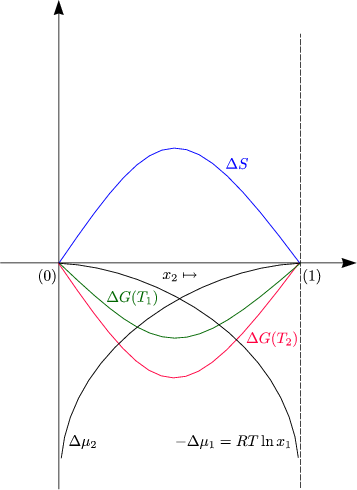
Die Entropiedifferenz berechnet sich nun durch Subtraktion der Entropien vor und nach dem Mischvorgang:
Mit ![]() =
= ![]() =
= ![]() und der analogen Beziehung für x1 ergibt sich:
und der analogen Beziehung für x1 ergibt sich:
| Wir groß ist |
Für xi![]() 1 gilt
1 gilt ![]() i
i![]()
![]() i
i![]() .
.
Dies ist die Definition für eine ideale Mischung.
| Wie sieht es mit realen Mischungen aus? |
Der Ansatz ist nun ![]() i =
i = ![]() i
i![]() + RT lnxi + Korrektur =
+ RT lnxi + Korrektur = ![]() i
i![]() + RT lnxi + RT ln
+ RT lnxi + RT ln![]() i
mit dem Aktivitätskoeffizienten
i
mit dem Aktivitätskoeffizienten ![]() i und der Aktivität ai = xi
i und der Aktivität ai = xi![]() i. Fassen wir
zusammen:
i. Fassen wir
zusammen:
ai = ![]() ixi nennt man Aktivität und
ixi nennt man Aktivität und ![]() i bezeichnet man als
Aktivitätskoeffizient. Für eine ideale Mischung oder Lösung ist
i bezeichnet man als
Aktivitätskoeffizient. Für eine ideale Mischung oder Lösung ist ![]() i
i ![]() 1,
sonst aber gilt
1,
sonst aber gilt ![]() i
i![]() 1.
1.