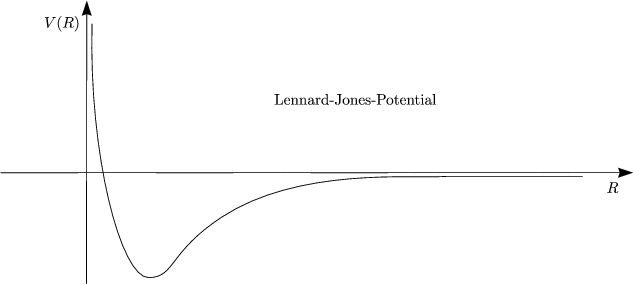

Näherung von V (R) durch harte Kugel Potential V hs (hard sphere potential)

| Wie ist das makroskopische Zustandsvolumen von Gasen zu beschreiben, oder mit anderen Worten V = V (p,T)? |
Wir kehren nun zu dem Problem zurück, wie sich das Volumen eines Gases in Abhängigkeit von Druck und Temperatur verändert. Wir suchen also die Funktion V = V (p,T). Ein Gedankenexperiment (Fahrradpumpe) soll uns weiterhelfen:
Wobei die Einheit des Druckes 1bar ist und 1bar = 105 Pa mit 1Pa = 1![]()
Die Einheit der Temperatur ist (T + 273,15)K; Kelvin-Skala
n![]() Molzahl bzw.
Molzahl bzw. ![]()
![]() Molares Volumen bzw. Molvolumen
Molares Volumen bzw. Molvolumen
![]() Résumé:
Résumé:
p . V = n . R . T
Dies ist die Zustandsgleichung idealer Gase mit der Gaskonstante R = 8,31![]() und
dem molaren Volumen V m = 22,4
und
dem molaren Volumen V m = 22,4![]() bei 273,15K und 1atm. Man kann die
Funktion V (p,T) folgendermaßen mittels der partiellen Ableitungen als totales
Differential schreiben:
bei 273,15K und 1atm. Man kann die
Funktion V (p,T) folgendermaßen mittels der partiellen Ableitungen als totales
Differential schreiben:
Läßt sich dV als totales Differential schreiben, so gibt es eine Potentialfunktion, die wegunabhängig ist. Das heißt:
| Unter welchen Bedingungen dV |
| Es gilt der Schwarz’sche Satz, welcher angewandt auf V (p,T), folgendermaßen lautet: |
| |
| Wie kann man den Druck mikroskopisch interpretieren (für ideales Gas, d.h. pV = nRT)? |
Wir betrachten folgendes Modell:
Der Impulsübertrag für eine Molekel i ergibt sich durch:
Durch Summation über N erhalten wir den Impulsübertragung auf Wand senkrecht zu x für N Molekeln: Daraus ergibt sich dann der Druck auf Wand senkrecht zu x:
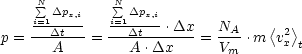
Aufgrund der unregelmäßigen Bewegung der Molekeln können wir folgenden Zusammenhang zwischen der mittleren Geschwindigkeit <v> und den jeweiligen gemittelten Komponenten <vx>, <vy> und <vz> angeben:
Fassen wir unsere Erkenntnisse zusammen:
p = p(V,T) ist eine Funktion von mehreren Variablen. Eine solche
Funktion läßt sich anschaulich als eine Fläche im Raum darstellen.
Läßt sich eine Funktion als totales Differential schreiben, so ist ![]() dV
wegunabhängig.
dV
wegunabhängig.