- Mechanismus
- Parametrisierung (=mathematische Formulierung der Zeitabhängigkeiten)
1 Sekunde ![]() 9192631720 Schwingungen der elektromagnetischen Strahlung,
die bei einem Hyperfeinübergang von Cs emittiert wird
9192631720 Schwingungen der elektromagnetischen Strahlung,
die bei einem Hyperfeinübergang von Cs emittiert wird
Zeitskalen in der Chemie:
| Zeit | Ereignis |
| 6 . 1017 s | Alter des Universums |
| 5 . 103 s | diese Vorlesung |
| 10-4 s | schnellste enzymkatalytische Reaktionen |
| 10-12 s | Zeitskalen von Schwingungen in Molekülen |
| 10-16 s | schnellste chemisch relevante Prozesse |
| Zahl | Bezeichnung |
| 1012 | tera |
| 106 | mega |
| 10-3 | milli |
| 10-6 | micro |
| 10-9 | nano |
| 10-12 | piko |
| 10-15 | femto |
| 10-18 | okto |
Beispiel:
2CO +O2Beispielsweise ist dies eine Reaktion der Form A+B ![]() P.
P.
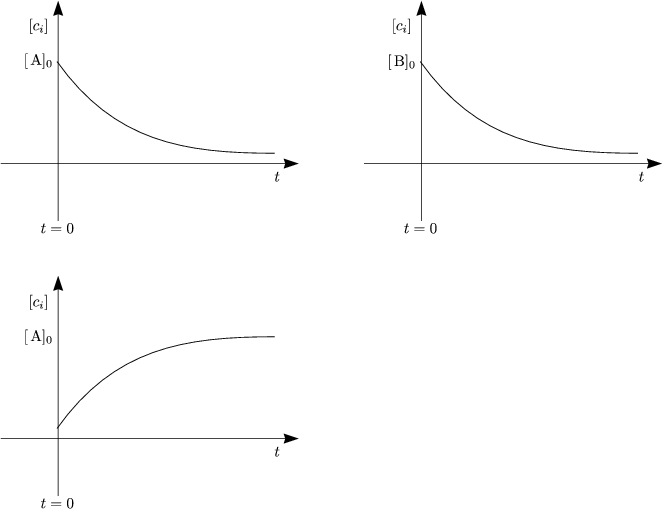
Historische Nebenbemerkung:
Die erste kinetische Messung wurde im Rahmen der Rohrzuckerinversion AK ist hierbei die sogenannte Geschwindigkeitskonstante.
Wir dividieren durch V und erhalten:
Dies ist ein Beispiel für ein Geschwindigkeitsgesetz erster Ordnung.
Wir führen die Reaktionslaufzahl ein, welche die Änderung der Anteile der Edukte und Produkte einer chemischen Reaktion entlang eines Reaktionsweges beschreibt:
![]() nimmt nur Werte zwischen 0 und 1 an.
nimmt nur Werte zwischen 0 und 1 an.
Die Reaktionsgeschwindigkeit läßt sich damit schreiben als:
Für homogene Reaktionen ist nützlich:
Die Integration führt zu ci(t).
Es gilt immer:
f![]() hängt vom Mechanismus ab und nicht von
stöchiometrischen Koeffizienten in
hängt vom Mechanismus ab und nicht von
stöchiometrischen Koeffizienten in ![]() i
i![]() iBi = 0.
iBi = 0.
Beispiele:
- Co+Cl2
 CoCl2
CoCl2
![--d[Co] 1 32
dt = K[Co] [Cl2]](ch436x.gif)
Die Ordnung in Co ist 1, die Ordnung in Cl2 ist 0,5 und die Gesamtordnung beträgt 1,5.
- A+B
 ']K C
']K C
![- d[A] K[A][B]
--dt--= [B]+-K'[C]](ch438x.gif)
- 2N2O5
 4NO2+O2
4NO2+O2
![-1 d[N2O5]-= K[N2O5]1
2 dt](ch439x.gif)
Für Bi ![]() Edukte, mi
Edukte, mi ![]() Reaktionsordnungen,
Reaktionsordnungen, ![]() imi
imi ![]() Gesamtordnung
Gesamtordnung
K haben ![]() imi-abhängige Einheiten.
imi-abhängige Einheiten.
Man unterscheidet diese nach Molekularität:
- Monomolekular: zum Beispiel I2
 2I (Gasphase, hochverdünnt),
(A
2I (Gasphase, hochverdünnt),
(A  B)
B)
- Bimolekular: zum Beispiel NO + O3
 NO2 + O2 (Gasphase,
hochverdünnt), (A + B
NO2 + O2 (Gasphase,
hochverdünnt), (A + B  C + D)
C + D)
- Trimolekular: Dreierstöße (umstritten!)