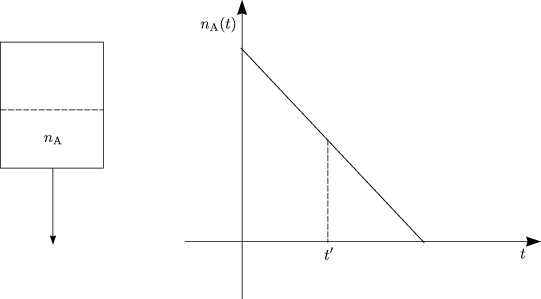

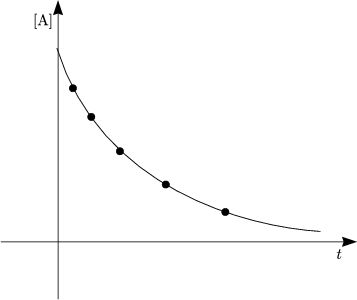
Dies ist eine Differentialgleichung 1.Ordnung, die wir durch Trennung der Veränderlichen lösen:
Nun werden beide Seiten integriert und wir erhalten:
![[A integral ] integral t
d[A] = -k1 dt
[A] t=0
[A]0](ch456x.gif)
Indem wir jetzt beide Seiten exponieren und nach [A] auflösen, erhalten wir:
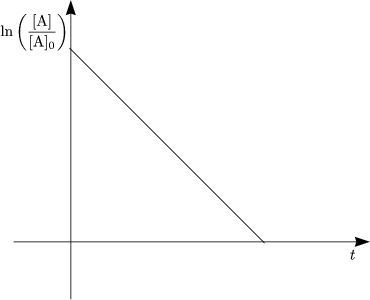
Die Dimension von k1 ist ![]() . Wir erhalten dann für die Halbwertszeit t1/2:
. Wir erhalten dann für die Halbwertszeit t1/2:
Die mittlere Lebensdauer ist ![]()
![]() [A] = [A]e-1 = [A]exp
[A] = [A]e-1 = [A]exp![]() .
.
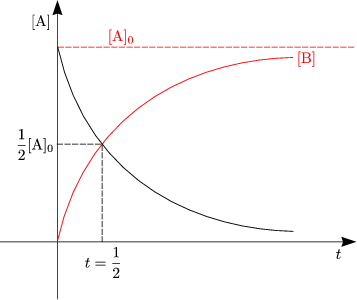
Wir nehmen an, daß [B]0 = 0 gilt.
Ein Beispiel hierfür ist die Isomerisierung. kA und kB sind Reaktionsgeschwindigkeitskonstanten erster Ordnung.
Via Massenerhalt
läßt sich diese Differentialgleichung noch vereinfachen:
Es gilt:
Nach Integration folgt lnx = -(kA + kB)t + C.
Einsetzen von t = 0 ergibt:
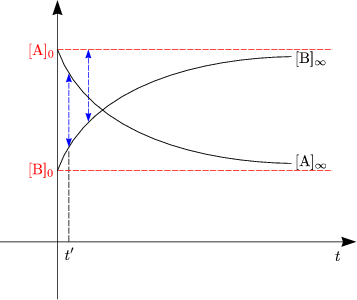
Daraus ergibt sich:
|
| (6.1) |
 Betrachten wir die
Reaktion:
Betrachten wir die
Reaktion:
![integral [A] integral t
d[A] = -2k dt
[A]2 2
[A]0 0](ch490x.gif)
Damit erhalten wir folgende Halbwertszeit:
Es handelt es um eine Reaktion 2.Ordnung. Die Halbwertszeit ist abhängig von der Anfangskonzentration. Eine manchmal nützliche Darstellung ist:
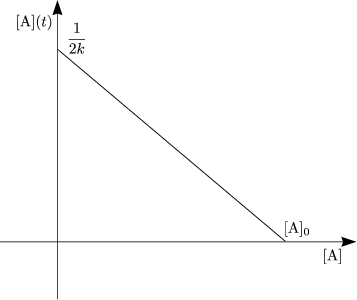 Diese Darstellung
basiert auf:
Diese Darstellung
basiert auf:
Wir multiplizieren mit ![]() und erhalten:
und erhalten:
![integral x dx integral t
([A]---x)([B]---x)-= k2 dt
0 0 0 0](ch501x.gif)
Zur Integration müssen wir eine Partialbruchzerlegung durchführen:
Diese Gleichung gilt jedoch nicht für [A]0 = [B]0. Wenn [B]0 » [A]0 und x « [B]0 ist, ist folgende Näherung nützlich:
![( )
[B] - ~ [B]0-- > [A] - ~ [A]0exp -k2[B]0 t
--'--
k2](ch504x.gif)
Es handelt sich also um eine Kinetik pseudo-erster Ordnung.