In der Theorie der Kinetik wird mit Adsorption der Vorgang bezeichnet, wenn Gase an der Oberfläche von Feststoffen haften bleiben. Hierbei wird der Feststoff, auf dessen Oberfläche sich die Gasteilchen festsetzen, Adsorptiv genannt. Das Gas, welches adsorbiert wird, heißt Adsorben. Dieser Prozeß kann auf verschiedene Art und Weise von statten gehen:
- Physikalische Adsorption (Physisorption):
Sie wird durch Van-der-Waals-Kräfte hervorgerufen. Es handelt sich dabei nur um zwischenmolekulare Kräfte. Die Teilchen werden nicht chemisch gebunden, sondern lagern sich aufgrund dieser schwachen Anziehungskräfte an der Oberfläche an. Die Energie, welche hier frei wird, befindet sich in der Größenordnung der Verdampfungswärme. Bei der physikalischen Adsorption kann eine Schicht enstehen, die aus mehreren Moleküllagen besteht.
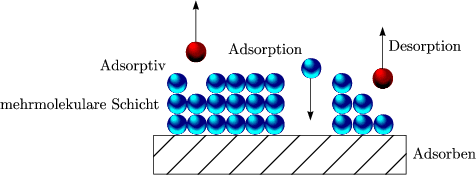
- Chemische Adsorption (Chemisorption):
Anders als die physikalische Adsorption, enstehen bei der chemischen Adsorption Bindungen zwischen den Gasteilchen und den Teilchen an der Oberfläche des Festkörpers. Es ist daher einsichtig, das es sich hierbei um eine chemische Reaktion handelt, bei der größere Energien frei werden, als bei der Physisorption. Es bildet sich jedoch nur eine einmolekulare Schicht aus.
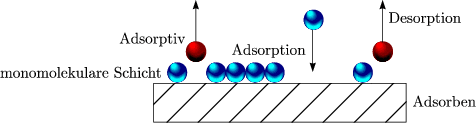
Wir können uns die Adsorption bildlich folgendermaßen vorstellen:
Mechanismus:

Die Adsorption ist vom Partialdruck der Gasphase und der Anzahl der freien Plätze auf dem Absorptiv abhängig. Wir betrachten den Prozeß mathematisch und führen die folgenden Größen ein:
![]() kann Werte zwischen 0 und 1 annehmen, wobei 0 der Wert ist, welcher dafür
steht, daß die Oberfläche noch ungedeckt ist. Der Wert 1 bedeutet, daß die
maximale Anzahl von besetzten Plätzen erreicht ist. Die zeitliche Änderung von
kann Werte zwischen 0 und 1 annehmen, wobei 0 der Wert ist, welcher dafür
steht, daß die Oberfläche noch ungedeckt ist. Der Wert 1 bedeutet, daß die
maximale Anzahl von besetzten Plätzen erreicht ist. Die zeitliche Änderung von
![]() ist die Geschwindigkeit, mit welcher sich die Anzahl der zu besetzenden
Plätze ändert. Sie setzt sich aus 2 Anteilen zusammen:
ist die Geschwindigkeit, mit welcher sich die Anzahl der zu besetzenden
Plätze ändert. Sie setzt sich aus 2 Anteilen zusammen:
- Geschwindigkeit der Adsorption:
Diese ist proportional zum Anteil der freien Plätze 1 -
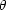 und zum Druck p der Gasphase. Daher können wir mit der
Geschwindigkeitskonstante k1 schreiben:
und zum Druck p der Gasphase. Daher können wir mit der
Geschwindigkeitskonstante k1 schreiben:
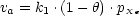
- Geschwindigkeit der Desorption:
Dies ist der Vorgang, der entgegengesetzt der Adsorption stattfindet. Dessen Geschwindigkeit ist nur proportional zur Anzahl der besetzten Plätze:
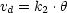
Durch Addition der beiden Geschwindigkeiten, ergibt sich die gesamte
Änderung an besetzten Plätzen ![]() :
:
Im Gleichgewicht (t![]()
![]() ) ist diese Geschwindigkeit gleich 0 und wir
erhalten:
) ist diese Geschwindigkeit gleich 0 und wir
erhalten:
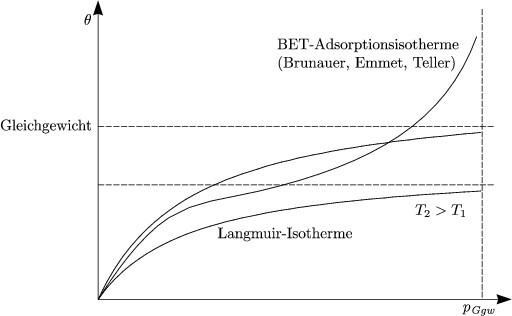
Dies ist die Gleichung für die sogenannte Langmuir-Isotherme, welche eine Annäherung an die Realität darstellt. Es kann aber auch passieren, daß die Kurve der Adsorption nicht asymptotisch gegen einen bestimmten Grenzwert abfällt, wie das bei der Langmuir-Isotherme der Fall ist, sondern daß sie nach einiger Zeit sehr stark ansteigt. Dieser Vergleich macht folgendes Schaubild klar:
Dieser Ansatz ist eine Annäherung an die Realität.
- A
 B
B
- A
 2]k1 A(
2]k1 A(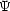 )
)
- A (
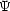 )
)  k5 (k5 sehr klein)
k5 (k5 sehr klein)
- B (
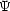 )
) 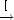 4]k3 B(g)
4]k3 B(g)
Differentialgleichung:
 ~ 0 = k1(1 -
~ 0 = k1(1 - 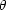 A -
A - 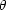 B)pA - k2
B)pA - k2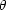 A(-k5
A(-k5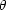 A) (*)
A) (*)
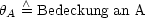
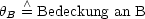
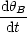 ~ 0 = k3(1 -
~ 0 = k3(1 - 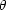 A -
A - 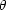 B)pB - k4
B)pB - k4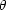 B(+k5
B(+k5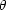 A)
A)
Nach Umformung ergibt sich:
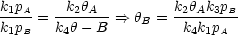

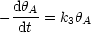

S ist Oberfläche in Einheiten von Anzahl der Adsorptionsplätze.
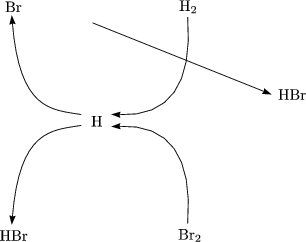
- Kettenreaktion ohne Verzweigung (Stöchiometrie: H2 (g) + Br2(g)
 2HBr(g)
2HBr(g)
- Br2
 k12Br
k12Br
Teilschritt der Initiierung
- Br + H2
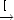 k2HBr + H
k2HBr + H
- H + Br2
 k2HBr + Br
k2HBr + Br
b.) und c.) sind die Kettenwachstumsschritte der Kettenreaktion.
- H + HBr
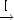 H2 + Br
H2 + Br
Teilschritt der Inhibierung
- Br + Br + (M)
 Br2(+M)
Br2(+M)
Teilschritt des Kettenabbruchs; Br,H
 Kettenträger
Kettenträger
Differentialgleichungen:
![d[Br]
dt](ch691x.gif) = 2k1[Br2] - k2[Br][H2] + k3[H][Br2] + k4[H][HBr] - 2k5[Br]2
= 2k1[Br2] - k2[Br][H2] + k3[H][Br2] + k4[H][HBr] - 2k5[Br]2  0
0
Wir nehmen Quasistationarität an.
![d[H]
dt](ch692x.gif) = k2[Br][H2] - k3[H][Br2] - k4[H][HBr]
= k2[Br][H2] - k3[H][Br2] - k4[H][HBr]  0
0
Addition von (1) und (2) ergibt:
![(k [Br ])12
[Br] = -1---2
k5](ch693x.gif)
Aus (2) und [Br] ergibt sich nach Umformung:
![( )1
k2 k1[kBr2] 2 [H2]
[H] =------5--------
k3[Br2]+k4[HBr]](ch694x.gif)
![d[HBr] = k2[Br][H2]+ k3[H][Br]- k4[H][HBr]
dt](ch695x.gif)
Wir substituieren [H] und [Br] und formen um:
![' 3 ( )1
d[HBr]= -k-[H2][Br2]2--, k'= 2k2 k1 2 ,k''= k4
dt [Br2]+ k''[HBr] k5 k3](ch696x.gif)
Aus der Massenbilanz ergibt sich wiederum:
![2d[Br2]= - d[Br]- d[HBr]
dt dt dt](ch697x.gif)
Und hieraus folgt:
![( ) -1
d[Br2] 1 ( k1 )12
-dt--= - 2+ 2 k5[Br]](ch698x.gif)
- Br2
- Kettenreaktion mit Verzweigung
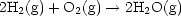
- Mechanismus:
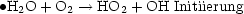

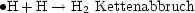
Dies ist eine formelle Behandlung von Kettenreaktion mit Verzweigung: A
 C).
C).
- Mechanismus:
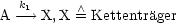
- Verzweigung:
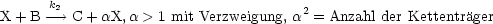
- Abbruch:
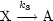
![==> d[X]-= k [A] - k [B][X]+ aK - 2[X][B]- k [X]
dt 1 2-------- --------- 3
k2(a-1)[B][X]](ch707x.gif)
Wir nehmen an, daß das Quasistationaritätsprinzip gilt:
![k1[A]
[X] ~~ k---k(a---1)[B]
3 2](ch708x.gif)
![==> c /\ = k3- k2(a- 1)[B]](ch709x.gif)
![[X] ~~ -----k1[A]------= k1[A]
k3- k2(a- 1)[B] c](ch710x.gif)
Zunächst ist Quasistationarität nur sinnvoll, wenn k3 > k2(
 -
1)[B]. Wir führen eine Grenzwertbetrachtung für
-
1)[B]. Wir führen eine Grenzwertbetrachtung für 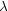 durch. Die
exakte Lösung der Differentialgleichung für [X]0 = 0; [A] und [B]
im Überschuß ist:
durch. Die
exakte Lösung der Differentialgleichung für [X]0 = 0; [A] und [B]
im Überschuß ist:
![ka[A] k1[A]
[X]t = k3--k2(a--1)[B] (1- exp(- (k3 - k2(a - 1)[B])t) =-c-(1- exp(-2t))](ch711x.gif)
- Fallunterscheidung:
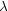 > 0: Analog zu Kettenreaktion ohne Verzweigung
> 0: Analog zu Kettenreaktion ohne Verzweigung
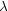 < 0: [X]t =
< 0: [X]t = ![k1[A]
-|c|--](ch712x.gif)

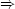 divergiert.
divergiert.
Eine Kettenexplosion ist die Folge.
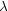 = 0: Über l’Hospital-Regel erhält man [X]t = k1[A]t.
= 0: Über l’Hospital-Regel erhält man [X]t = k1[A]t.
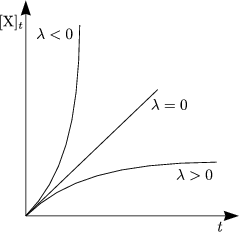
Wirklichkeit:
Systeme mit Kettenverzweigungsmechanismen können Kettenexplosion (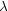 < 0) und Wärmeexplosion (hängt zusammen mit
Abführung von
< 0) und Wärmeexplosion (hängt zusammen mit
Abführung von  Hr (Wärmeleitung)) aufweisen.
Hr (Wärmeleitung)) aufweisen.
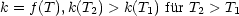
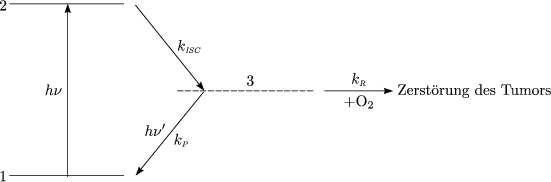
- Mechanismus:
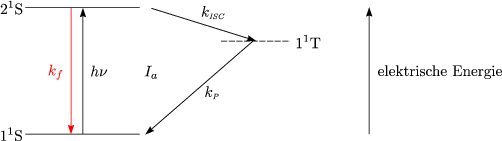
![( ) hn ( )
M 11S + Energieeinheiten --> M 21S 1.) Ia Photonenabsorption
M (21S)-k-F--> M (11S)+ hn 2.) k [21S] Fluoreszenz
F- --
( ) k ( ) Photonenersatz
M 21S --IS-C--> M 11T 3.) Intersystem Crossing
( 1 ) kR ( 1 )
M (1 T) +kPR ---->( M )1 S 4.) Bimolekulare Reaktion der Triplet-Zust¨ande
M 11T ----> M 11S +hn' 5.) Phosphoreszenz](ch726x.gif)