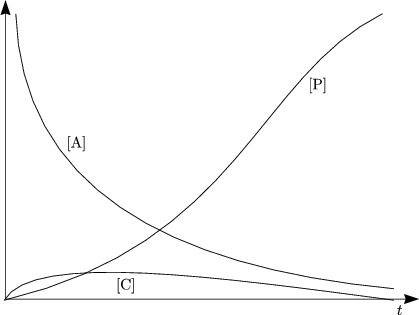
Des weiteren gilt [C]0 = 0, womit folgt:
- A
 k1B
k1B
- A
 k2C
k2C
- B
 k-1A
k-1A
- C
 k-2A
k-2A
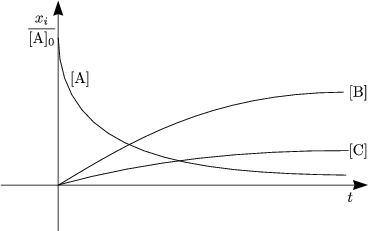
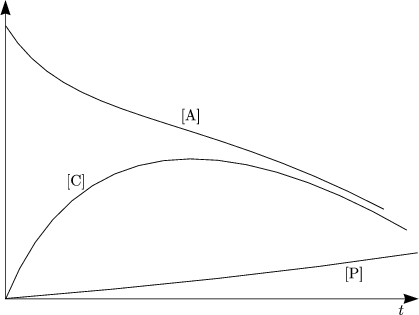
Wir erwarten Gleichgewicht bei großem t:
Aus der Differentialgleichung folgt bei t = ![]() :
:
Hieraus ergibt sich:
Beispiel:

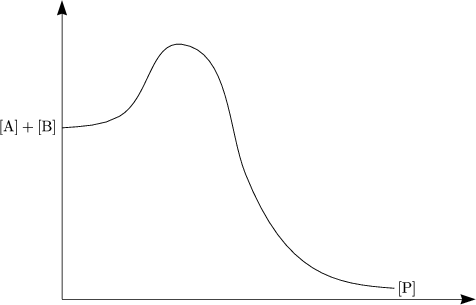
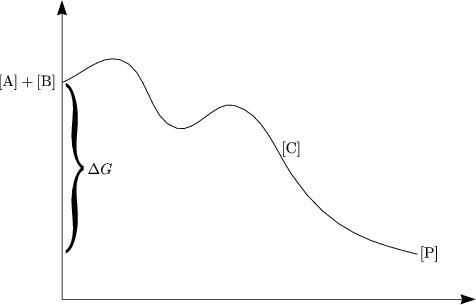
- „Kinetische Kontrolle“
- „Thermodynamische Kontrolle“
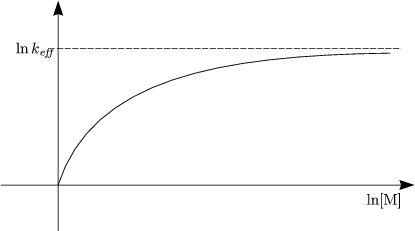
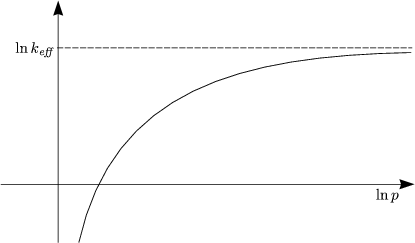
![( )
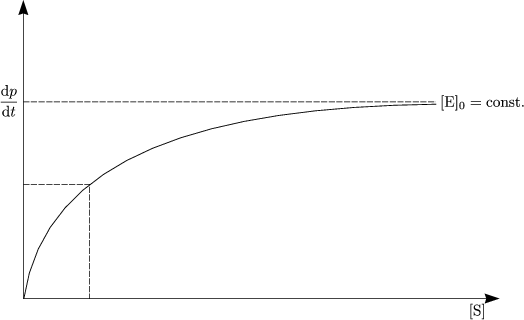
Kb[E]0 1- [[PS]]K-
---(Ks-)--(Ks[P])-
1+ [S] + Kp[S]](ch657x.gif)