
Wahrscheinlichkeit NA, [v,v + dv]
Wie groß ist F(v)?
Schließlich läßt sich die Gesamtwahrscheinlichkeit durch Integration über alle möglichen Geschwindigkeiten finden; diese muß gerade den Wert 1 haben:
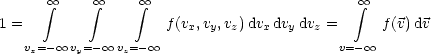
Die Maxwell-Annahme ist nun, daß f(vx), f(vy) und f(vz) nicht gekoppelt sind, da
das Gas isotrop ist. Diese lassen sich also separat betrachten. Wir nehmen an, daß
sich f(![]() ) somit als Produkt dreier unabhängiger Funktionen bezüglich einer einzigen
Geschwindigkeitskomponente schreiben läßt:
) somit als Produkt dreier unabhängiger Funktionen bezüglich einer einzigen
Geschwindigkeitskomponente schreiben läßt:
Dann wenden wir den Logarithmus auf obige Gleichung an:
Wir leiten die Funktion nach vx ab und erhalten:
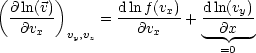
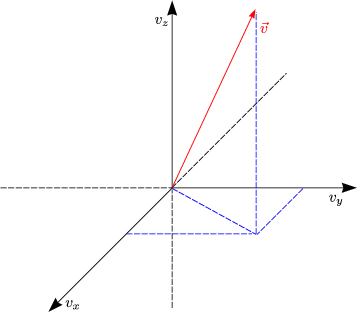
Mit v = ![]() ergibt sich nun:
ergibt sich nun:
Wir multiplizieren das ganze mit ![]() durch:
durch:
Durch Integration dieser Differentialgleichung erhalten wir:
Des weiteren werten wir die Normierungsbedingung aus:
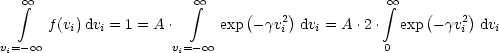
Dies funktioniert auch analog für vx und vz.
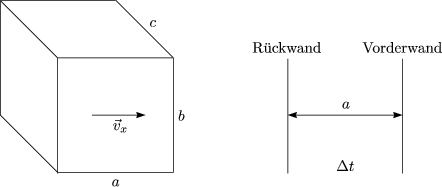
Der übertragene Impuls berechnet sich dann durch ![]() p =
p = ![]() (vx) = 2mvx. Wir
berechnen außerdem die Kraft als zeitliche Impulsänderung:
(vx) = 2mvx. Wir
berechnen außerdem die Kraft als zeitliche Impulsänderung:
Wir dividieren F durch die Fläche b . c, womit der Druck resultiert:
Der Druck, den ein Teilchen i erzeugt, lautet pi = ![]() . Durch Summation über alle
Teilchen N erhalten wir den Gesamtdruck:
. Durch Summation über alle
Teilchen N erhalten wir den Gesamtdruck:
Mit der mittleren quadratischen Geschwindigkeit
läßt sich dies schreiben als:
Es gilt, da es sich um ein isotropes Gas handelt und somit der Betrag der Geschwindigkeit unabhängig von der Richtung ist:
Das ideale Gasgesetz lautet, wie wir wissen pV = nRT;
Damit gilt für die mittlere quadratische Geschwindigkeit, wobei M die Molmasse ist:
Allgemein gilt für den Mittelwert eine Funktion g(x):

Wir wenden dies auf unser Problem an:
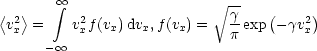
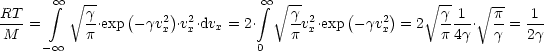
Damit erhalten wir die eindimensionale MAXWELL-BOLTZMANN-Geschwindigkeitsverteilung:

 | (7.1) |
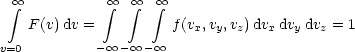
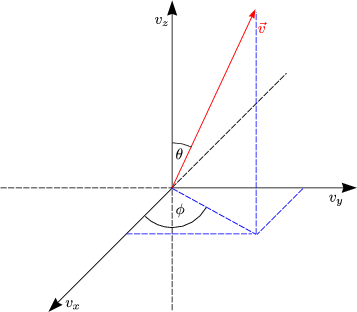
Zur Berechnung des Integrals führen wir Kugelkoordinaten ein:
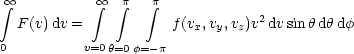
Die Lösung ist:
Exponentialfunktion ![]() Harmonisches Ensemble
Harmonisches Ensemble
Die Wahrscheinlichkeit, ein Teilchen zu finden mit v zwischen v und v+dv (irgendwo gerichtet im Raum), berechnet sich folgendermaßen:
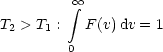
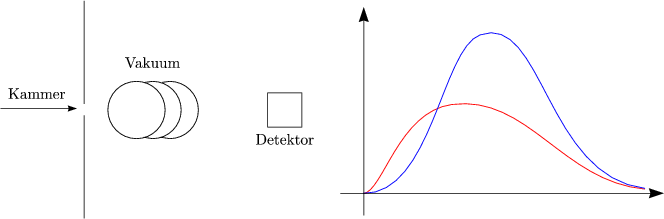
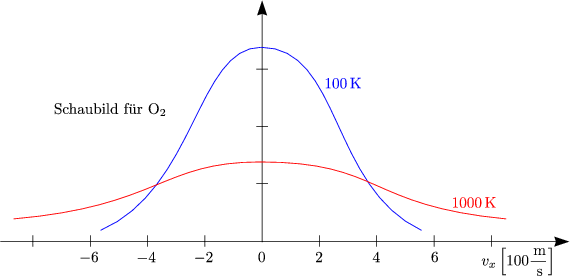
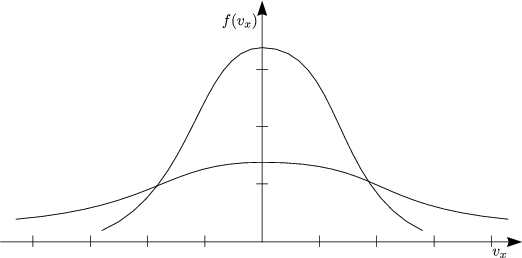
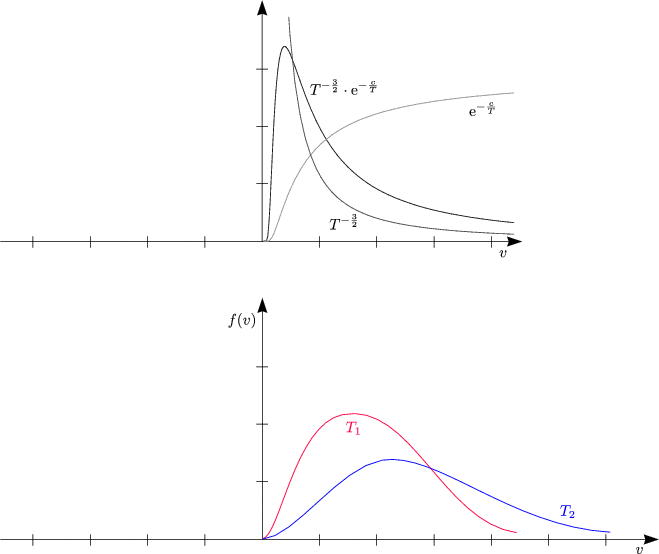
Das Schaubild zeigt das Aussehen der Verteilungsfunktion bei zwei verschiedenen Temperaturen T1 und T2.
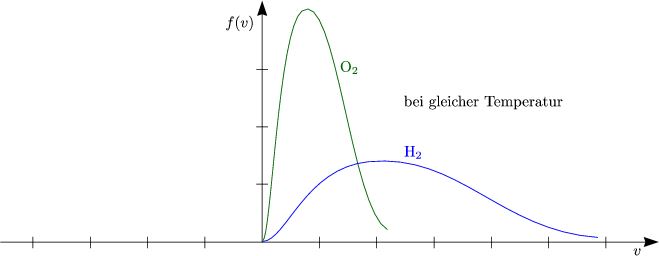
Das folgende Schaubild zeigt die Verteilungsfunktion für zwei verschiedene Gase, nämlich für Sauerstoff und Wasserstoff.
Wir suchen jetzt eine Verteilungsfunktion der Relativgeschwindigkeiten bei Stoß zwischen A und B.
Diese erhält man als Extremwert durch Ableiten der Geschwindigkeitsverteilung und Nullsetzen:

m ist hierbei die Teilchenmasse und M die molare Masse.
Diese berechnet sich durch Integration:

(v ist hier kein Vektor!)
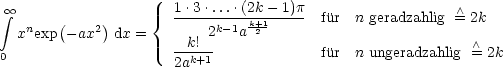
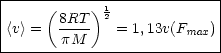
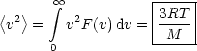
| Gas | |
| H2 | 1692 |
| He | 1204 |
| N2 | 454 |
| Hg | 170 |
Es gilt kbimolekular ![]() |vrel|. |vrel| kann durch folgendes zunächst furchterregendes
Integral berechnet werden:
|vrel|. |vrel| kann durch folgendes zunächst furchterregendes
Integral berechnet werden:
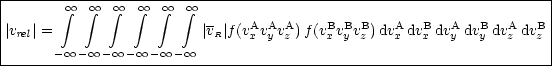
Die genaue Lösung findet sich in MOORE/HUMMEL: Physical Chemistry.

![]() AB ist hierbei die reduzierte Masse der beiden Teilchen:
AB ist hierbei die reduzierte Masse der beiden Teilchen:

Wir haben jetzt in unserer Formel eine T-Abhängigkeit aber noch kein
exp![]() .
.