

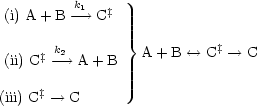
Kp läßt sich über (statistische) Thermodynamik (Zustandssummen (siehe Einsteinmodell)) bestimmen:
gi ist hierbei der Entartungsfaktor. Die Energie ![]() i ist gegeben durch
i ist gegeben durch ![]() i = h
i = h![]() . v,
wobei mit v die Schwingungsquantenzahl ist (v = 0, ...,
. v,
wobei mit v die Schwingungsquantenzahl ist (v = 0, ..., ![]() ) und q die entsprechende
Zustandssumme.
) und q die entsprechende
Zustandssumme.
Analog läßt sich für Reaktionsgemisch ein Ausdruck für Gl(l![]() alle beteiligten
Substanzen) herleiten. Oben wird die Kenntnis sämtlicher energetischer
Freiheitsgrade benötigt. Über
alle beteiligten
Substanzen) herleiten. Oben wird die Kenntnis sämtlicher energetischer
Freiheitsgrade benötigt. Über ![]() G aus der statistischen Thermodynamik kommt man
zu einem Ausdruck für Kp:
G aus der statistischen Thermodynamik kommt man
zu einem Ausdruck für Kp:
q(C‡), q(A) und q(B) sind die jeweiligen molekularen Zustandssummen.
Die Annahme 2 führt dann zu:
Wir nehmen aus Zustandssumme die aktive Schwingung heraus.
Dies ist allgemein formulierbar für unimolekulare (n = 1) und bimolekulare (n = 2) Reaktionen:
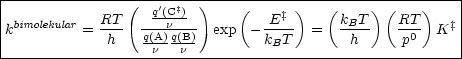
Die Aussage ist also folgende:

![|--------------------|----[cm3-]|---------|
|--------------------|Aexp-mol.s-|ATAK-----|
|D + H2 --> HD + H |5.1013 |3,5 .1013 |
|Br + H2-- > HBr + H |3.1013 |1 .1014 |
-H-+-CH4--->-H2-+-CH3---1.1013-----2-.1013---](ch975x.gif)