
Die Emission ist unabhängig von chemischer Natur. Sie hängt nur von der Temperatur ab (Beispiel: Ofen, Sonne). Wir machen somit ein Experiment:


Planck hat hergeleitet, daß doe Energien diskret aber nicht kontinuierlich sind. Es
liegt eine Quantelung E = n . h . ![]() vor. Eine Anleihe aus der statistischen
Thermodynamik ist die Plancksche Strahlungsformel:
vor. Eine Anleihe aus der statistischen
Thermodynamik ist die Plancksche Strahlungsformel:

h ![]() 6,626 . 10-34 Js ist das Plancksche Wirkungsquantum. Die Quantelung der
Energie E ist ein Widerspruch zur klassischen Physik.
6,626 . 10-34 Js ist das Plancksche Wirkungsquantum. Die Quantelung der
Energie E ist ein Widerspruch zur klassischen Physik.
Das Rayleigh-Jeans-Gesetz war ursprünglich klassisch über kontinuierliche Energieverteilung abgeleitet worden. Das Gesetz führt zur „UV-Katastrophe“ bei hohen Frequenzen.
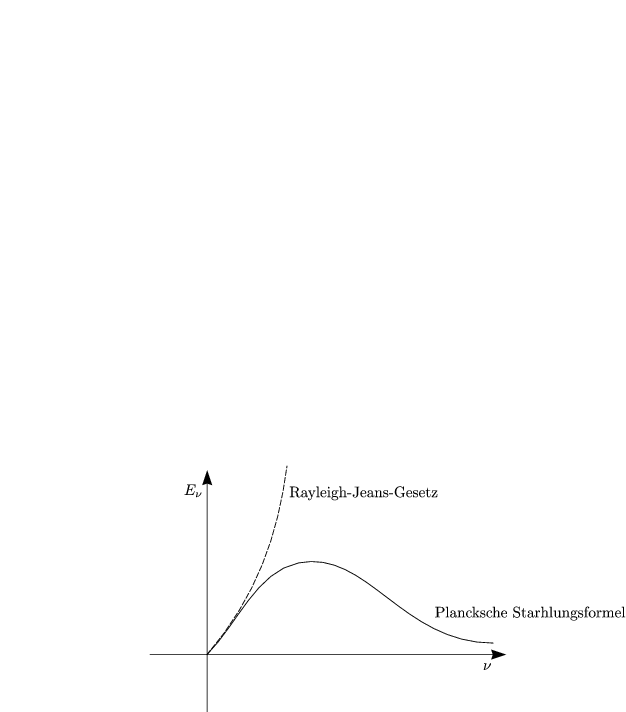
Die Lage des Intensitätsmaximums genügt dem Wienschen Verschiebungsgesetz:
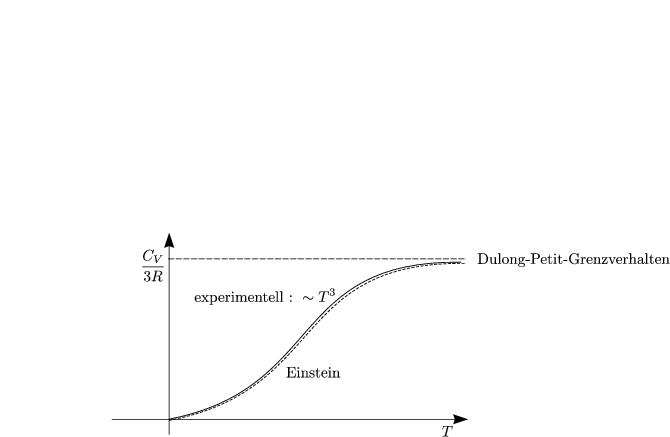
In Physikalische Chemie I hatten wir folgende Beziehung hergeleitet:

Der photoelektrische Effekt zeigt die Teilchennatur des Lichts (1887: Heinrich Hertz; 1905: Albert Einstein).

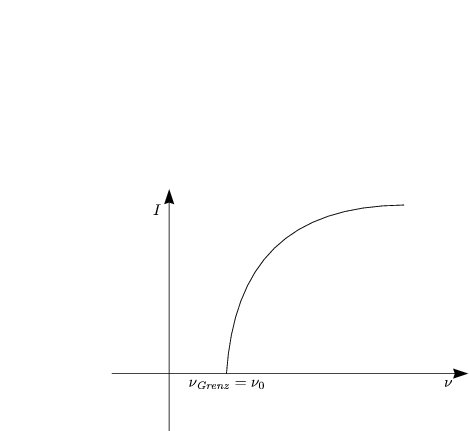
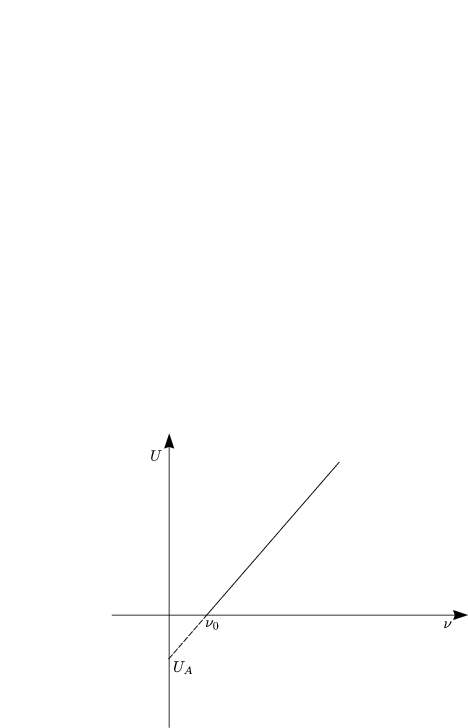
Die Kathode besteht aus Metall wie beispielsweise Cäsium.
UA ist ein Schwellenwert; er spiegelt die Austrittsarbeit eines Elektrons aus dem Metall wider.
Die Elektronenzahl hängt nur von der Intensität ab, nicht von der Energie. Die quantenmechanische Erklärung ist, daß die Strahlungsenergie nur in diskreten Beiträgen absorbiert wird.
Falls Lichtquanten (mit E = h![]() ) sich wie Teilchen verhalten, sollten sie auch Impuls
haben. Relativistisch betrachtet gilt m =
) sich wie Teilchen verhalten, sollten sie auch Impuls
haben. Relativistisch betrachtet gilt m = ![]() =
= ![]() . Mit p = mc folgt p =
. Mit p = mc folgt p = ![]() . Den
experimentelle Beweis hat COMPTON im Jahre 1922 erbracht bei der Streuung von
Röntgenstrahlen an Graphit.
. Den
experimentelle Beweis hat COMPTON im Jahre 1922 erbracht bei der Streuung von
Röntgenstrahlen an Graphit.
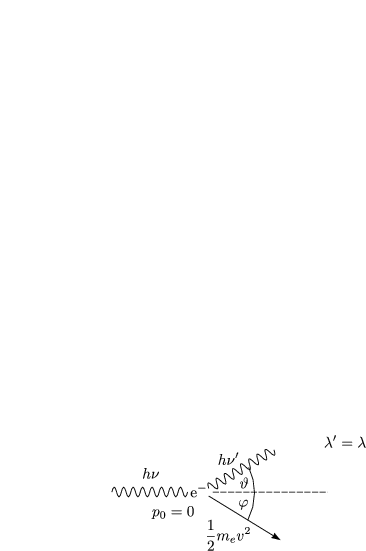
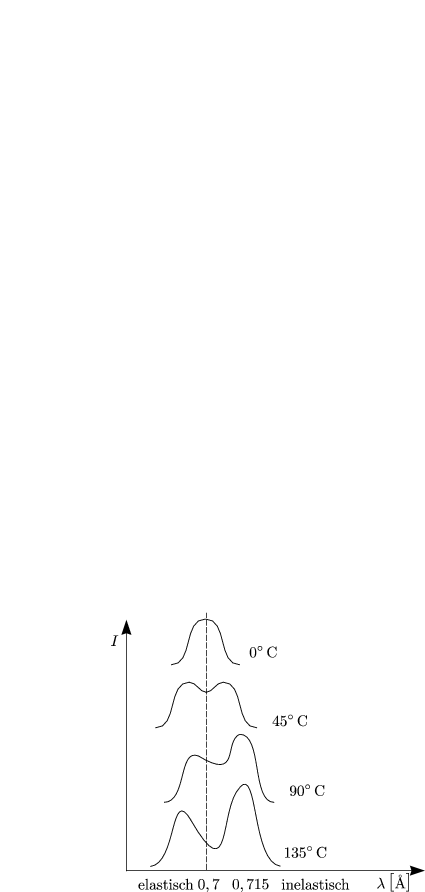
Die klassische Erwartung ist, daß es einen viel größeren ![]() -Verschiebungsbereich gibt,
welcher anhängig von h
-Verschiebungsbereich gibt,
welcher anhängig von h![]() ist (Originalexperiment: K
ist (Originalexperiment: K![]() -Strahlung von Molybdän auf
Graphit).
-Strahlung von Molybdän auf
Graphit).
Aus diesen drei Gleichungen ergibt sich:

Daraus folgt, daß Photonen korpuskular sind.