Auswahlregeln beschreiben die Wechselwirkung elektromagnetischer Strahlung mit Materie
![]() (0) beschreibt das ungestörte System und
(0) beschreibt das ungestörte System und ![]() (1) eine kleine, zeitabhängige
Lösung wie beispielsweise -
(1) eine kleine, zeitabhängige
Lösung wie beispielsweise -![]() E0 cos(2
E0 cos(2![]()
![]() t). Das Verfahren zur Lösung der
Schrödinger-Gleichung ist die zeitabhängige Störungstheorie. Übergänge
finden nur dann statt, wenn |
t). Das Verfahren zur Lösung der
Schrödinger-Gleichung ist die zeitabhängige Störungstheorie. Übergänge
finden nur dann statt, wenn |![]() fi|
fi|![]() 0 ist. Man spricht dann auch von
der allgemeinen Auswahlregel. Spezielle Auswahlregeln sind beispielsweise
0 ist. Man spricht dann auch von
der allgemeinen Auswahlregel. Spezielle Auswahlregeln sind beispielsweise
![]() J = ±1 („+“ steht für Absorption, „-“ für Emission).
J = ±1 („+“ steht für Absorption, „-“ für Emission).
Die Moleküle HCl, H2O und NH3 besitzen ein Rotationsspektrum, während aber N2 und CH4 kein Rotationsspektrum haben.
Man kann zeigen, daß A21 ~|![]() |2 und B12 = B21 ~|
|2 und B12 = B21 ~|![]() |2 gilt.
|2 gilt.
Für ein beliebiges Objekt ist die Rotationsenergie klassisch wie folgt gegeben:
Lx, Ly, Lz sind die Komponenten des Drehimpulses und Ix, Iy, Iz die jeweiligen Trägheitsmomente (senkrecht zueinander). Wir teilen die Moleküle in 4 Gruppen ein:
Beispiele sind hier die Moleküle CH4 oder auch SF6.
Hier sei HCl und CO2 angeführt.
Beispiele sind H2O, CH3OH und das DNS-Molekül.
Zu diesen 4 Gruppen formulieren wir die Rotationsenergie:
Es gilt Lx2 + Ly2 + Lz2 = L2![]() J(J + 1)
J(J + 1)![]() 2 für J = 0, 1, 2, ....
2 für J = 0, 1, 2, ....
Man bezeichnet B1 und B2 als Rotationskonstanten.
Mit J, der Gesamtdrehimpulsquantenzahl und K, der Quantenzahl für die Richtungsquantisierung, (Drehimpuls in Richtung der Kreiselachse) erhalten wir:
Für A und C gilt:
Wegen K2 sind Rotationsniveaus zweifach entartet. Die Auswahlregeln
sind ![]() J = ±1 und
J = ±1 und ![]() K = 0.
K = 0.
Betrachten wir für K = 0 die Energie E(J) = BJ(J+1) mit J = 0, 1, 2, .... Uns interessieren Energieniveaus und Spektrum des Rotationsübergangs:
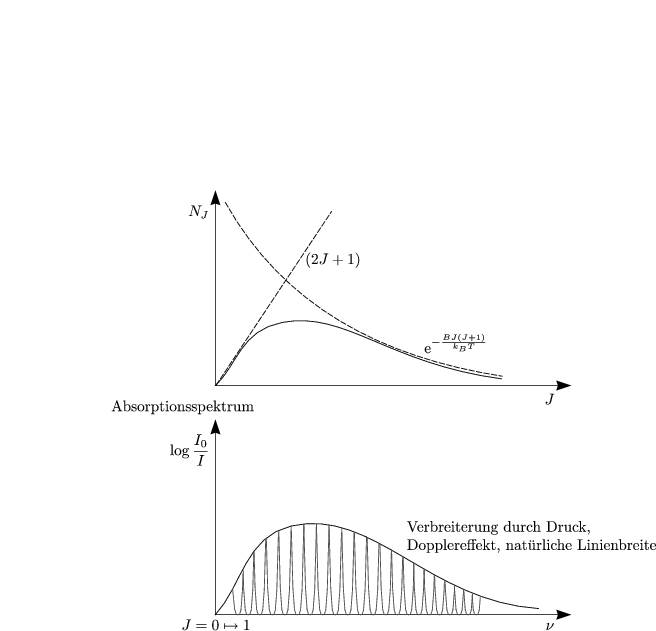
Abstände zwischen Rotationsübergängen läßt sich aus dem Spektrum ablesen.
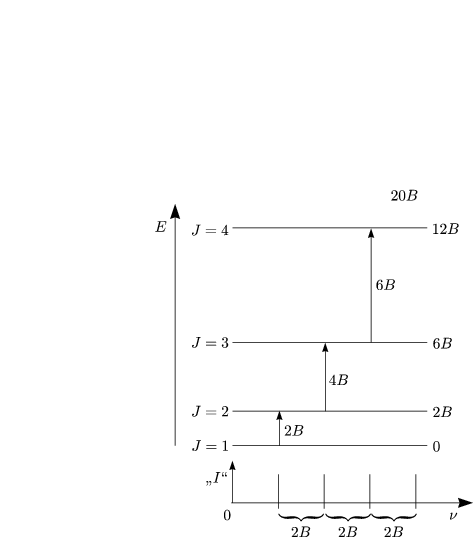
Die Auswahlregel bedingt für den starren Rotator den gleichen
Abstand (2B). Für zweiatomige Moleküle ist die Bestimmung
des Bindungsabstandes möglich, da B ~ ![]() =
= ![]() ist. Bei
zweiatomigen Molekülen benötigt man die Isotopensubstitution und
Isotopenspektroskopie zur Bestimmung von R.
ist. Bei
zweiatomigen Molekülen benötigt man die Isotopensubstitution und
Isotopenspektroskopie zur Bestimmung von R.
Kompliziertes Energieschema und Spektrum, demnach sehr erfolgreich bei kleinen Molekülen wie beispielsweise H2O und O3.
Durch Lösung der Schrödinger-Gleichung erhält man
D ist die Zentrifugalverzerrungskonstante mit der Einheit ![]() .
.
Die BOLTZMANN-Verteilung dient zur Beschreibung der Besetzungsdichte der einzelnen Niveaus:


Die allgemeine Auswahlregel ist durch die anisotrope Polarisierbarkeit ![]() rel =
rel = ![]() . E
gegeben. Anisotropie bedeutet, daß die Polarisierbarkeit von der Richtung des Feldes
relativ zum Molekül abhängt. CH3 und SF6 sind jedoch weder mikrowellen-, noch
Rotations-Raman-aktiv (sphärische Kreisel). Die spezielle Auswahlregeln sind
. E
gegeben. Anisotropie bedeutet, daß die Polarisierbarkeit von der Richtung des Feldes
relativ zum Molekül abhängt. CH3 und SF6 sind jedoch weder mikrowellen-, noch
Rotations-Raman-aktiv (sphärische Kreisel). Die spezielle Auswahlregeln sind
![]() J = ±2,
J = ±2, ![]() J = 0. Dies ist jedoch trivial; es findet keine Energieänderung statt,
sondern man beobachtet nur Rayleigh-Streuung.
J = 0. Dies ist jedoch trivial; es findet keine Energieänderung statt,
sondern man beobachtet nur Rayleigh-Streuung.