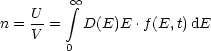
Die spezifische Wärme einfacher Metalle läßt sich über die innere Energie berechnen:
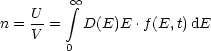
Bei T = 0 findet man dann, wobei wir f(E,T) bis zur Fermienergie EF durch eins ersetzen können:
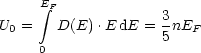
EF beträgt xeV. Bei Zimmertemperatur 300K ist dies ![]() eV. Diese ist riesig
verglichen mit Gas bei 300K. Für die spezifische Wärme kommt nur ein kleiner
Anteil in Frage:
eV. Diese ist riesig
verglichen mit Gas bei 300K. Für die spezifische Wärme kommt nur ein kleiner
Anteil in Frage:
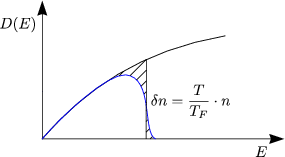
Der Energiezuwachs für jedes dieser Elektronen ist ![]() E
E ![]() kBT, womit sich
ergibt:
kBT, womit sich
ergibt:
Damit folgt außerdem:
Man kann diese Berechnung jedoch auch genauer durchführen. Dazu schreiben wir:
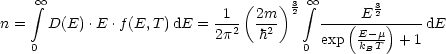
Dieses Integral ist jedoch leider analytisch nicht lösbar. Für kBT « EF können wir folgende Näherung machen:
Damit können wir die spezifische Wärme schließlich bestimmen:
Der erste Faktor folgt durch „Reduktion“ wegen der Fermistatistik. Der zweite Term
beschreibt einen freien Gasanteil. Man muß sich deshalb merken CV el ![]() T! Dies gilt
bei „allen“ Temperaturen. Die Temperaturbereiche, für welche dies nicht mehr gilt,
sind experimentell meistens sowieso unzugänglich. Die gesamte spezifische Wärme
eines Metalls ergibt sich durch Addition des Anteil durch die Phononen und des
Anteils der Elektronen:
T! Dies gilt
bei „allen“ Temperaturen. Die Temperaturbereiche, für welche dies nicht mehr gilt,
sind experimentell meistens sowieso unzugänglich. Die gesamte spezifische Wärme
eines Metalls ergibt sich durch Addition des Anteil durch die Phononen und des
Anteils der Elektronen:
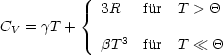
![]() und
und ![]() sind hierbei übliche Abkürzungen. Für hohe Temperaturen dominiert
folglich der 3R-Anteil. In der folgenden Schreibweise wird verdeutlicht, daß die
Wärmekapazität von der Masse und Dichte der Elektronen abhängt:
sind hierbei übliche Abkürzungen. Für hohe Temperaturen dominiert
folglich der 3R-Anteil. In der folgenden Schreibweise wird verdeutlicht, daß die
Wärmekapazität von der Masse und Dichte der Elektronen abhängt:
Obwohl wir eine sehr einfache Theorie benutzen, stimmen die theoretischen Werte mit den experimentellen gut überein.
| Li | Na | Al | Cu | Ag | |
| | 1,63 | 1,38 | 1,35 | 0,70 | 0,65 |
| | 2,18 | 1,26 | 1,48 | 1,38 | 1,00 |
Bekannt sind sowohl n als auch m. Experimentell variiert der Quotient aus ![]() exp und
exp und
![]() theo von etwa 1 bis 2. Der Unterschied wird durch Einführung einer effektiven
Massen mth* („th“
theo von etwa 1 bis 2. Der Unterschied wird durch Einführung einer effektiven
Massen mth* („th“ ![]() thermisch) berücksichtigt.
thermisch) berücksichtigt.
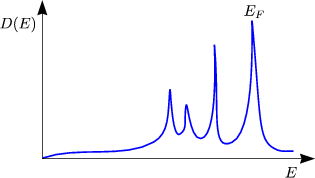
m* spiegelt also die Wechselwirkung mit dem Gitterpotential wider. Bei den Übergangsmetallen ist mth* oft sehr groß. Bei Nickel gilt beispielsweise mth* = 15m. Wegen den d-Elektronen sieht hier nämlich die Zustandsdichte anders aus:
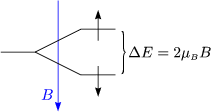
Im thermischen Gleichgewicht gilt:
Die Besetzungszahldifferenz ist dann gegeben durch:
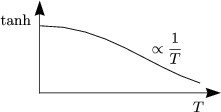
Es gibt für hohe T eine Magnetisierung (![]() BB « kBT).
BB « kBT).
Die Suszeptibilität beträgt daher:
Beispielsweise gilt dann für Natrium mit n(Na) bei 300K, daß ![]()
![]() 6,9 . 10-4 ist.
Experimentell erhält man jedoch einen Wert von
6,9 . 10-4 ist.
Experimentell erhält man jedoch einen Wert von ![]() = 8,3 . 10-6
= 8,3 . 10-6 ![]() T0. Unsere Theorie
ist damit falsch für freie Elektronen (aber korrekt für paramagnetische Ionen,
Curie-Gesetz). Deshalb berücksichtigen wir nun das Pauli-Prinzip:
T0. Unsere Theorie
ist damit falsch für freie Elektronen (aber korrekt für paramagnetische Ionen,
Curie-Gesetz). Deshalb berücksichtigen wir nun das Pauli-Prinzip:
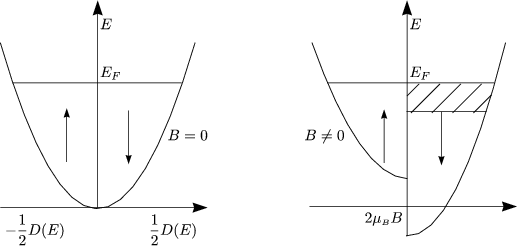
Überschuß von Elektronen mit Spin antiparallel zu B, ![]() parallel zu B. Wegen
parallel zu B. Wegen
![]() BB « EF gilt D(E
BB « EF gilt D(E ![]() EF)
EF) ![]() const. Daraus erhalten wir für den Überschuß der
Elektronen:
const. Daraus erhalten wir für den Überschuß der
Elektronen:
Dieses Verhalten entspricht damit dem Experiment. Man spricht auch vom
Pauli-Paramagnetismus. Weitere Korrekturen erhält man durch Berücksichtigung des
Bahn-Diamagnetismus und der effektiven Masse m![]() *.
*.
Das Fazit ist also, daß das freie Elektronengas/Fermigas eine gute Sache für einfache Metalle ist.
Führt man aber eine Messung der Ladungsträgerkonzentration durch den Halleffekt
durch, so stellt man fest, daß der Wert für Natrium stimmt. Im Beryllium verhalten
sich die Elektronen jedoch so, als wären sie positiv. Man mißt ![]() positive
Ladungsträger pro Atom.
positive
Ladungsträger pro Atom.